 |
|
Дослід 1. Одержання хлору
У пробірку покласти кристалик KMnO4 та додати 3 – 4 краплі концентрованої соляної кислоти. Відмітити колір та запах хлору, що виділяється. Дослідити дію хлору на йодкрохмальний папірець, що знаходиться в отворі пробірки. До складу йодкрохмального паперу входять йодид калію та крохмаль. Під дією хлору йодид-іон окислюється до І2, при наявності якого крохмаль синіє. Написати рівняння реакцій, що відбуваються.
Дослід 2. Розчинність галогенів в органічних розчинниках
У дві пробірки окремо набрати по 3 – 5 крапель розчинів броміду калію та йодиду калію. У кожну пробірку додати по 2 – 4 краплі хлорної води та 4 – 5 крапель бензолу чи бензину. Вміст пробірок збовтати. Відмітити колір “бензольного кільця”. Написати рівняння реакцій взаємного витіснення галогенів.
Дослід 3. Відновлення сірчаної кислоти
У дві пробірки покласти по 2 – 3 кристалики: у першу – NaBr, у другу – КІ. В кожну пробірку додати 2 – 4 краплі концентрованої сірчаної кислоти. Описати спостереження. Написати рівняння реакцій.
Дослід 4. Відновлення хлориду заліза(ІІІ)
У пробірку набрати 3 – 4 краплі розчину КІ, додати 3 – 4 краплі бензолу та 1 – 2 краплі розчину FeCl3. Збовтати вміст пробірки. Описати спостереження та написати рівняння реакції. Чи буде відбуватись реакція, якщо замість йодиду калію взяти хлорид чи бромід?
Дослід 5. Одержання галогенідів срібла
У 3 пробірки набрати по 3 – 4 краплі розчинів: у першу – NaCl, у другу – KBr, у третю – KI. У кожну пробірку додати по кілька крапель розчину нітрату срібла до утворення осадів. Написати рівняння реакцій.
Вправи
1. Які ступені окислення характерні для водню у його сполуках? Які типи хімічного зв’язку утворює атом водню в бінарних сполуках з іншими елементами?
2. Чи може існувати іон Н+?
3. З якими простими та складними речовинами реагує водень? Наведіть приклади.
4. Що спільного та відмінного є в будові та властивостях води та пероксиду водню?
5. Написати рівняння реакцій:
а) KMnO4+H2O2+H2SO4®
б) КІ+Н2О2+H2SO4®
в) H2O2+I2®
г) Na3[Cr(OH)6]+H2O2+NaOH®
д) CrCl3+H2O2+NaOH®
е) BaO2+HClконц®
6. Для наповнення аеростатів воднем іноді використовують взаємодію CaH2 з водою. Скільки кілограмів СаН2 треба використати, щоб одержати 500 м3 (н.у.) водню?
7. До 150 г розчину Н2О2 додали каталізатор МnO2. Виділився 1л О2 (н.у.). Яка масова частка Н2О2 у вихідному розчині?
8. Наведіть способи одержання пероксиду водню у промисловості, у лабораторії.
9. Охарактеризуйте кислотно-основну природу пероксиду водню. Наведіть приклади.
10. Яка електронна конфігурація атомів галогенів? Які ступені окислення можуть мати вони в сполуках? Чому фтор відрізняється від інших галогенів?
11. Як змінюється окисна активність галогенів у ряду F – At?
12. З якими простими та складними речовинами реагують галогени? Наведіть приклади.
13. Напишіть рівняння реакцій одержання галогеноводневих кислот.
14. Чому фтороводень має найбільш високу температуру кипіння, маючи найменшу молекулярну масу?
15. Як змінюється здатність утворювати водневі зв’язки у ряду НF – НІ?
16. Чому фтороводневу кислоту не можна зберігати у скляному посуді?
17. Як змінюється відновлююча здатність у ряду НF – НІ? Наведіть приклади.
18. Напишіть рівняння реакцій:
а) KMnO4+KI+H2SO4®
б) MnO2+KBr+H2SO4®
в) KClO3+HCl®
г) K2Cr2O7+HCl®
д) KBr+Cl2®
е) NaCl+H2SO4к®
є) NaBr+H2SO4к®
ж) NaI+H2SO4к®
з) MnO2+HCl®
19. Чому йодоводнева кислота на повітрі буріє?
20. Що таке галогенангідриди? Як вони взаємодіють з водою та розчинами лугів?
21. Чому ртуть розчиняється у йодоводневій кислоті? Які продукти цієї реакції?
22. Йод практично не розчиняється у воді, але розчиняється у розчині йодиду калію. Чому?
23. Чому алюміній і кремній утворюють з фторид-іонами [AlF6]3-та [SiF6]2-, а бор та берилій – [BF4]- та [BeF4]2-?
24. Поясніть високу реакційну здатність суміші HCl з HNO3. Чому в ній розчиняються речовини, на які не діють індивідуальні кислоти?
25. Знайти масу йоду, що виділяється при взаємодії надлишку йодиду калію з 300 г підкисленого сірчаною кислотою розчину перманганату калію з ω(KMnO4)=6%.
26. Який склад хлорної, бромної та йодної води?
27. Напишіть рівняння реакцій одержання Cl2O та F2O. Який ступінь окислення кисню в цих сполуках?
28. Що таке ”жавелева вода”, хлорне вапно, як їх одержують?
29. Як змінюється сила, стійкість та окисні властивості кислот у ряду HClO –HBrO – HIO?
30. Як одержати хлорати, бромати, йодати? Напишіть рівняння відповідних реакцій.
31. Як одержати хлорнувату та хлорну кислоти? Напишіть рівняння реакцій.
32. Як змінюється сила та окисні властивості кислот у ряду HClO3 – HBrO3 –HIO3?
33. Як змінюються сила, стійкість та окисні властивості кислот у ряду HClO – HClO2 – HClO3 – HClO4?
34. Як одержати Cl2O7?
35. Які сполуки мають більш сильні окисні властивості: кисневмісні кислоти галогенів чи їх солі?
36. Напишіть рівняння реакцій:
а) NaOH + Cl2 ®
б) Ca(OH)2 + Cl2 ®
в) КOH + F2O ®
г) KOH + Br2 ®
д) KIO3 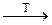
е) I2 + HNO3 ®
є) ClO2 + KOH ®
ж) HClO + H2S ®
з) CaOCl2 + CO2 + H2O ®
и) KClO4 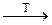
і) HClO4 + P2O5 ®
й) Cl2O6 + KOH ®
к) KBrO3 + KBr + H2SO4 ®