 |
|
ОСНОВНІ ЗАЛЕЖНОСТІ І РОЗРАХУНКОВІ ФОРМУЛИ ДО РОЗДІЛУ І
1. Способи вираження складу фаз двокомпонентних систем “рідина – газ (пара)” наведені у табл. I.1.
Таблиця I.1
| Концентрація | Позначення концентрації компонента А | |
| у рідкій фазі | у газовій або паровій фазі | |
Мольна частка, 
| x | y |
Масова частка, 
| 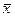
| 
|
Відносна мольна концентрація (частка), 
| X | Y |
Відносна масова концентрація (частка), 
| 
| 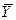
|
Об’ємна мольна концентрація, 
| 
| 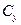
|
Об’ємна масова концентрація, 
| 
| 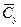
|
Формули для перерахунку концентрацій (у рідкій фазі) наведені в табл. I.2, де 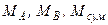 – мольні маси компонентів у суміші, кг/кмоль;
– мольні маси компонентів у суміші, кг/кмоль; 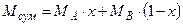 ;
;  – густина суміші,
– густина суміші, 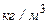 .
.
Для ідеальних газів:
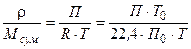 .
.
Для газової (парової) фази справедливі такі самі співвідношення, але з заміною позначень Х на Y.
1.1. Вагові і мольні частки
Компоненти A, B, … , K, …, N, їх вагові частки 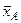 ,
, 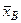 , …,
, …, 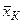 , …,
, …,  і молекулярні маси компонентів дорівнюють
і молекулярні маси компонентів дорівнюють 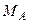 ,
,  , …,
, …, 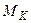 , …,
, …,  . Кількість часток будь-якого компонента, наприклад, компонента K, що припадає на 1кг суміші, становить
. Кількість часток будь-якого компонента, наприклад, компонента K, що припадає на 1кг суміші, становить 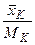 .
.
Вміст цього компонента у суміші (в молекулярних частках)
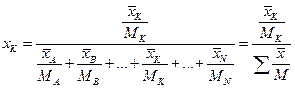 .
.
Для зворотного перерахунку виразимо вагові частки 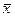 компонентів через мольні частки
компонентів через мольні частки  .
.
Маси окремих компонентів, що містяться в 1кмолі суміші, становлять:
 .
.
Відповідно вагова частка компонента:  .
.
1.2. Об’ємні концентрації і вагові частки
Об’ємні концентрації компонентів: 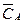 ,
, 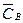 , …,
, …,  , …,
, …,  , кг/м3.
, кг/м3.
Сума  – маса суміші в 1м3 об’єму, або густина
– маса суміші в 1м3 об’єму, або густина 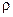 суміші. Вагова частка будь-якого (наприклад, K-го) компонента виражається через його об’ємну концентрацію
суміші. Вагова частка будь-якого (наприклад, K-го) компонента виражається через його об’ємну концентрацію  так:
так:
 .
.
1.3. Відносні концентрації
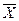 ,
,  – відносні вагові концентрації компонента, що розподіляється у взаємодіючих фазах
– відносні вагові концентрації компонента, що розподіляється у взаємодіючих фазах 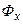 і
і  відповідно, тобто кількість його, що припадає на 1кг носія у кожній фазі.
відповідно, тобто кількість його, що припадає на 1кг носія у кожній фазі.
 Таблиця I.2
Таблиця I.2
| Вираз концен-трації компо-нента А | x | 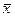
| X | 
| 
| 
|
| x | – |  або
або

| 
| 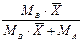
| 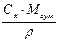 або
або

| 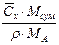 або
або
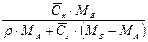
|
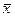
| 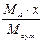
| – | 
| 
| 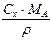
| 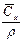
|
| X | 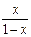
| 
| – | 
| 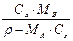
| 
|

| 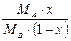
| 
| 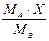
| – | 
| 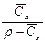
|

| 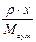
| 
| 
| 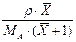
| – | 
|

| 
| 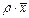
| 
| 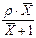
| 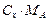
| – |

1.4. Відносні концентрації. Вагові і мольні частки
Нехай аміак поглинається водою. Відносна концентрація NH3 складає в рідкій фазі  кг/кг води, в газовій фазі
кг/кг води, в газовій фазі  кг/кг повітря. Вагові концентрації через відносні розраховуються за залежностями:
кг/кг повітря. Вагові концентрації через відносні розраховуються за залежностями:
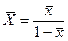 ;
; 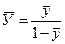 .
.
2. Концентрація компоненту в газовій фазі може бути виражена також через його парціальний тиск. На основі рівнянь Клапейрона і Дальтона мольна (об’ємна) частка (y) будь-якого компонента суміші ідеальних газів дорівнює:
 ; (I.1.)
; (I.1.)
або
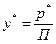 , (I.1а)
, (I.1а)
де р – парціальний тиск компоненту газової суміші;  – парціальний тиск поглинутого газу, який знаходиться в рівновазі з розчином;
– парціальний тиск поглинутого газу, який знаходиться в рівновазі з розчином; 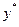 – мольна (об’ємна) частка компонента суміші ідеальних газів, що є рівноважною з рідиною;
– мольна (об’ємна) частка компонента суміші ідеальних газів, що є рівноважною з рідиною; 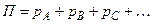 – загальний тиск суміші газів або парів, що дорівнює сумі парціальних тисків всіх компонентів.
– загальний тиск суміші газів або парів, що дорівнює сумі парціальних тисків всіх компонентів.
3. Закон Генрі:
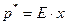 , (I.2)
, (I.2)
або
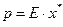 , (I.2а)
, (I.2а)
де  – мольна частка розчиненого газу в розчині,
– мольна частка розчиненого газу в розчині,  – концентрація газу в розчині (у мольних частках), що є рівноважним з газовою фазою, в якій парціальний тиск поглинутого компонента дорівнює
– концентрація газу в розчині (у мольних частках), що є рівноважним з газовою фазою, в якій парціальний тиск поглинутого компонента дорівнює 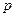 ;
;  – коефіцієнт пропорційності, який називають коефіцієнтом, або константою Генрі.
– коефіцієнт пропорційності, який називають коефіцієнтом, або константою Генрі.
Числові значення коефіцієнта Генрі для заданого газу залежать від природи поглинача і газу і від температури, але не залежать від загального тиску в системі.
Значення Е для водних розчинів деяких газів наведені в табл. 8Д.
Підставляючи значення парціального тиску з рівняння (I.2) в рівняння (I.1а), отримуємо:
 . (I.3)
. (I.3)
Або, підставляючи значення парціального тиску з рівняння (I.2а) в рівняння (I.1), отримуємо:
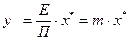 , (I.3а)
, (I.3а)
де  – безрозмірний коефіцієнт (коефіцієнт розподілення), сталий для даної системи “газ – рідина” при t = const та П = const. Також він є тангенсом кута нахилу лінії рівноваги.
– безрозмірний коефіцієнт (коефіцієнт розподілення), сталий для даної системи “газ – рідина” при t = const та П = const. Також він є тангенсом кута нахилу лінії рівноваги.