 |
|
Способы восстановления, способствующие повышению качества железных порошков. Металлотермические способы получения порошков железа.
Такими способами восстановления являются хлоридный способ и содовый способ восстановления. Сущность содового способа заключается в совмещении процессов восстановления и химического рафинирования железосодержащего сырья кальцинированной содой Na2CO3: при нагреве шихты до 700 0С и выше оксиды железа восстанавливаются натрием, а примеси (кислородные соединения кремния, алюминия, кальция, магния, марганца, хрома, титана, вольфрама, молибдена, мышьяка, фосфора и др.) образуют растворимые в воде и разбавленных кислотах натриевые алюминаты, силикаты, фосфаты и другие соединения типа NaAlO2, Na2SiO3, Na3PO4, Na2O·3TiO2·2,5H2O, NaCrO2, Na2WO4, Na2MoO4, Na3AsO4, Na2O·Al2O3·2SiO2 (например, Al2O3 + Na2CO3 → Na2O·Al2O3 + CO2, SiO2 + Na2CO3 → Na2O·SiO2 + CO2 и т.п.); соединения кальция, магния и марганца могут давать промежуточные углекислые соли CaCO3, MgCO3, MnCO3, которые уже при 500 0С будут разлагаться, образуя оксиды, легко растворимые в разбавленных кислотах. Расчетное количество соды должно быть взято с четырех- или пятикратным избытком против его теоретически рассчитанного на связывание указанных выше кислородных соединений. Затем проводят гидрометаллургическую обработку спека, в результате которой получают порошок железа высокой чистоты. Взаимодействие карбоната натрия с оксидом железа (III), начиная с 700 0С, происходит достаточно быстро с образованием феррита натрия по реакции Fe2O3 + Na2CO3 → Na2O·Fe2O3 + CO2. Однако в восстановительной атмосфере (создаваемой газом-восстановителем и окисляющимся твердым углеродом) при 500-600 0С оксид железа (III) восстанавливается до низших оксидов, а при более высоких температурах – до металлического железа, в связи с чем указанная перед этим реакция ферритизации не происходит.
Сода при восстановлении действует каталитически, ускоряя как процесс газификации углерода (графита) за счет внедрения ионов натрия в межбазисные пространства его кристаллической решетки, так и кристаллохимические превращения в исходных оксидах железа при взаимодействии ионов натрия с поверхностью частиц.
По одному из вариантов (НПО "Тулачермет") сырьем служит высокосортный рудный концентрат или прокатная окалина, а твердым восстановителем – нефтяной кокс.
Хлоридный способ.Сущность этого гидрометаллургического метода заключается в растворении исходного железосодержащего материала (обрезь проката, отходы при производстве листа и т.п.) в соляной кислоте с образованием раствора хлористого железа (примеси и балластные вещества отделяются в виде нерастворимого остатка) и последующем его восстановлении водородом с получением чистого порошка железа.
В основе процесса лежит реакция: Fe + 2HCl = FeCl2 + H2 –87,6 кДж, протекающая в первой фазе процесса (растворение железа, содержащегося в исходном материале) слева направо, а на заключительной стадии (восстановление полученного хлорида железа водородом) справа налево; промежуточные стадии процесса (фильтрация раствора хлорида железа, его упаривание и кристаллизация) протекают с изменением агрегатного, но не химического состояния перерабатываемого продукта.
В обогреваемый паром герметичный реактор 1 с кислотостойкой футеровкой, снабженный мешалкой, загружают стальной (чугунный) скрап, стружку, лом и т.п. или дешевую железную губку (природное окисное сырье нецелесообразно из-за трудного растворения в соляной кислоте и по некоторым другим соображениям). Затем в реактор заливают соляную кислоту концентрации 15-20% и ведут выщелачивание при 60-80 0С. Выделяющийся при растворении железа водород пропускают через очистители 2 для улавливания HCl, H2S и после осушителя 3 с помощью компрессора 4 направляют в восстановительную печь 12. Раствор хлорида железа FeCl2 сливают в отстойник 5 и через фильтр 6 направляют в упариватель 7, где при разрежении 400-666,5 гПа и температуре 60 0С получают насыщенный горячий раствор. Его сливают в кристаллизатор 8, где при охлаждении до 15-20 0С выпадают кристаллы FeCl2·4Н2О (в них переходит до 75% Fe). Примеси, содержащиеся в исходном железосодержащем материале, остаются в отвальном кеке после фильтрации раствора, а небольшое количество некоторых примесей, перешедших в раствор (Ca, Mg и др.), остается в маточном растворе после выкристаллизовывания FeCl2·4Н2О. Выпавшие кристаллы хлорида железа после центрифуги 9 обезвоживают в сушильной камере 10 при температуре 60-200 0С и разрежении 266-400 гПа до состава FeCl2·2Н2О или FeCl2 и брикетируют на прессе 11, после чего направляют в восстановительную печь 12.
Хлорид железа плавится при 673 0С, поэтому восстановление ведут подогретым водородом при 550-600 0С в шахтной печи периодического действия с загрузкой большого количества брикетов или во вращающейся печи. Константа равновесия для реакции FeCl2 + H2 = Fe + 2HCl, равная 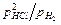 , при этих температурах имеет небольшую величину и равновесное парциальное давление водорода приблизительно в 7-8 раз выше парциального давления хлористого водорода, что вынуждает подавать водород в печь с большим избытком по отношению к количеству образующегося в единицу времени хлористого водорода. Продукт восстановления (слабо сцепленные частицы) подвергают измельчению в молотковой или вихревой мельнице.
, при этих температурах имеет небольшую величину и равновесное парциальное давление водорода приблизительно в 7-8 раз выше парциального давления хлористого водорода, что вынуждает подавать водород в печь с большим избытком по отношению к количеству образующегося в единицу времени хлористого водорода. Продукт восстановления (слабо сцепленные частицы) подвергают измельчению в молотковой или вихревой мельнице.
Избыточный водород и пары хлористого водорода, выходящие из восстановительной печи 12 поступают в водяной скруббер 14, где хлористый водород поглощается водой; раствор соляной кислоты перекачивают в напорный бак с соляной кислотой, расположенный над реактором 1. Водород, выходящий из скруббера, поступает по трубам через осушитель 3, присоединяется к очищенному водороду, выходящему из реактора 1, и подается в восстановительную печь 12. Таким образом, чистые соляная кислота и водород образуются и регенерируются в замкнутом цикле. Некоторые случайные потери водорода и соляной кислоты компенсируются подачей их свежих порций в систему.
Хлоридный способ применяют также для получения природнолегированных (2,5-8% легирующих элементов) порошков железа, используя близость кристаллических решеток хлоридов некоторых металлов (например, металлов триады железа).
Металлотермические способы получения железных порошков:
карбидотермический метод (восстановления прокатной окалины или богатой окисленной железной руды карбидом кальция. Исходные железосодержащий материал и карбид кальция размалывают в шаровой мельнице до крупности частиц не более 100 мкм, после чего смешивают их в барабанном смесителе в течение 3 ч (количество карбида кальция определяют расчетом из условия полного восстановления оксидов железа; железосодержащий компонент шихты перед смешиванием тщательно просушивают, так как влага может привести к взрыву из-за ее взаимодействия с СаС2). Шихту восстанавливают при 1100-1150 0С в течение 2-3 ч. В процессе нагрева (при 800-900 0С) карбид кальция диссоциирует с образованием металлического кальция и свободного углерода. Восстановительные процессы протекают по следующим суммарным реакциям:
Fe2O3 + 3Ca ↔ Fe + 3CaO, (3.35)
Fe2O3 + 3C ↔ Fe + 3CO. (3.36)
Образующийся оксид кальция взаимодействует с различными примесями:
CaO + SiO2 = CaO·SiO2, (3.37)
CaO + MnO = CaO·MnO, (3.38)
CaO + Al2O3 = CaO· Al2O3, (3.39)
CaO + C + FeS = Fe + CaS +CO. (3.40))
Гидридно-кальциевый метод (метод получения порошков сталей и сплавов сложного состава совместным восстановлением смеси оксидов (или смеси оксидов и металлических порошков) гидридом кальция. Восстановительная атмосфера газовой среды, предотвращая появление на поверхности образующихся металлических частиц оксидных пленок или восстанавливая имеющиеся на поверхности частиц исходного металлического порошка оксиды, обеспечивает хороший контакт между металлическими компонентами, что способствует протеканию диффузионных процессов и гомогенизации частиц порошка получаемого сплава. Избыток восстановителя нужен для полноты восстановления. Компоненты получаемого сплава, оксиды которых легковосстановимы, целесообразно вводить в шихту в виде порошков соответствующих металлов (например, порошки железа, меди, никеля, вольфрама, молибдена и др.), так как при этом сокращается расход дорогостоящего гидрида кальция. Смешивание проводят в атмосфере азота или аргона.
Трудновосстановимые оксиды, входящие в шихту, восстанавливаются гидридом кальция практически при одной и той же температуре 1150-1200 0С, причем в реакторе из нержавеющей стали, начиная с 400-500 и вплоть до 1200 0С, поддерживается атмосфера сухого и чистого водорода (гидрид кальция диссоциирует, выделяя водород, а появившийся кальций взаимодействует с образующейся при восстановлении оксидов водой по реакции Ca + H2O = CaO + H2). Когда шихта содержит мало трудновосстановимых оксидов, в нее рекомендуется вводить "разъединитель" (оксид кальция, хлористый натрий и др.), что облегчает последующую обработку спека, образовавшегося после проведения реакции. В процессе восстановления происходит агломерация металлических частиц, которой оксид кальция препятствует, а хлористый натрий способствует.
Выдержка при температуре восстановления зависит от скорости процесса диффузионного образования гомогенных частиц сплава и должна быть установлена экспериментально; обычно она составляет порядка 6-8 часов.
Разгрузку спека из реактора осуществляют либо струей воды под давлением 0,15-0,2 МПа, причем одновременно происходит его гашение (взаимодействие избытка СаН2 и образовавшегося СаО с водой), либо механически (тогда выгруженный из реактора спек дробят до крупности кусков 20-300 мм, размалывают и гасят большим избытком воды). Пульпу, полученную после гашения спека и содержащую порошок сплава и гидрооксид кальция, подвергают обогащению в гидроциклонах, позволяющих удалить 60-70% Са(ОН)2. Затем пульпу обрабатывают разбавленной соляной кислотой, переводя оставшийся в пульпе гидрооксид кальция в хорошо растворимый в воде хлористый кальций, который отмывают. После отмывки СаСl2 металлический порошок обрабатывают на центрифугах и высушивают в вакуумных сушильных шкафах при 60-70 0С.)