 |
|
Хлоридный способ получения порошков железа.
Сущность этого гидрометаллургического метода заключается в растворении исходного железосодержащего материала (обрезь проката, отходы при производстве листа и т.п.) в соляной кислоте с образованием раствора хлористого железа (примеси и балластные вещества отделяются в виде нерастворимого остатка) и последующем его восстановлении водородом с получением чистого порошка железа.
В основе процесса лежит реакция: Fe + 2HCl = FeCl2 + H2 –87,6 кДж, протекающая в первой фазе процесса (растворение железа, содержащегося в исходном материале) слева направо, а на заключительной стадии (восстановление полученного хлорида железа водородом) справа налево; промежуточные стадии процесса (фильтрация раствора хлорида железа, его упаривание и кристаллизация) протекают с изменением агрегатного, но не химического состояния перерабатываемого продукта.
В обогреваемый паром герметичный реактор 1 с кислотостойкой футеровкой, снабженный мешалкой, загружают стальной (чугунный) скрап, стружку, лом и т.п. или дешевую железную губку (природное окисное сырье нецелесообразно из-за трудного растворения в соляной кислоте и по некоторым другим соображениям). Затем в реактор заливают соляную кислоту концентрации 15-20% и ведут выщелачивание при 60-80 0С. Выделяющийся при растворении железа водород пропускают через очистители 2 для улавливания HCl, H2S и после осушителя 3 с помощью компрессора 4 направляют в восстановительную печь 12. Раствор хлорида железа FeCl2 сливают в отстойник 5 и через фильтр 6 направляют в упариватель 7, где при разрежении 400-666,5 гПа и температуре 60 0С получают насыщенный горячий раствор. Его сливают в кристаллизатор 8, где при охлаждении до 15-20 0С выпадают кристаллы FeCl2·4Н2О (в них переходит до 75% Fe). Примеси, содержащиеся в исходном железосодержащем материале, остаются в отвальном кеке после фильтрации раствора, а небольшое количество некоторых примесей, перешедших в раствор (Ca, Mg и др.), остается в маточном растворе после выкристаллизовывания FeCl2·4Н2О. Выпавшие кристаллы хлорида железа после центрифуги 9 обезвоживают в сушильной камере 10 при температуре 60-200 0С и разрежении 266-400 гПа до состава FeCl2·2Н2О или FeCl2 и брикетируют на прессе 11, после чего направляют в восстановительную печь 12.
Хлорид железа плавится при 673 0С, поэтому восстановление ведут подогретым водородом при 550-600 0С в шахтной печи периодического действия с загрузкой большого количества брикетов или во вращающейся печи. Константа равновесия для реакции FeCl2 + H2 = Fe + 2HCl, равная 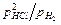 , при этих температурах имеет небольшую величину и равновесное парциальное давление водорода приблизительно в 7-8 раз выше парциального давления хлористого водорода, что вынуждает подавать водород в печь с большим избытком по отношению к количеству образующегося в единицу времени хлористого водорода. Продукт восстановления (слабо сцепленные частицы) подвергают измельчению в молотковой или вихревой мельнице.
, при этих температурах имеет небольшую величину и равновесное парциальное давление водорода приблизительно в 7-8 раз выше парциального давления хлористого водорода, что вынуждает подавать водород в печь с большим избытком по отношению к количеству образующегося в единицу времени хлористого водорода. Продукт восстановления (слабо сцепленные частицы) подвергают измельчению в молотковой или вихревой мельнице.
Избыточный водород и пары хлористого водорода, выходящие из восстановительной печи 12 поступают в водяной скруббер 14, где хлористый водород поглощается водой; раствор соляной кислоты перекачивают в напорный бак с соляной кислотой, расположенный над реактором 1. Водород, выходящий из скруббера, поступает по трубам через осушитель 3, присоединяется к очищенному водороду, выходящему из реактора 1, и подается в восстановительную печь 12. Таким образом, чистые соляная кислота и водород образуются и регенерируются в замкнутом цикле. Некоторые случайные потери водорода и соляной кислоты компенсируются подачей их свежих порций в систему.
Хлоридный способ применяют также для получения природнолегированных (2,5-8% легирующих элементов) порошков железа, используя близость кристаллических решеток хлоридов некоторых металлов (например, металлов триады железа).