 |
|
Уравнение баланса энтропии
В термодинамике неравновесных процессов принимается, что энтропия элементарного объёма 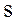 (локальная энтропия) является такой же функцией от внутренней энергии
(локальная энтропия) является такой же функцией от внутренней энергии 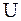 , удельного объёма
, удельного объёма 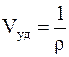 и концентрации
и концентрации  , как и в состоянии полного равновесия, и, следовательно, для неё справедливы обычные термодинамические равенства. Эти положения вместе с законами сохранения массы, импульса и энергии позволяют найти уравнение баланса энтропии
, как и в состоянии полного равновесия, и, следовательно, для неё справедливы обычные термодинамические равенства. Эти положения вместе с законами сохранения массы, импульса и энергии позволяют найти уравнение баланса энтропии
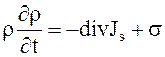 , (14.5)
, (14.5)
где s - скорость возрастания энтропии (локальное изменение энтропии на единицу объёма в единицу времени);
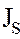 - плотность потока энтропии, которая выражается через плотности потока теплоты, диффузионного потока и ту часть тензора напряжений, которая связана с неравновесными процессами (т.е. через тензор вязких напряжений
- плотность потока энтропии, которая выражается через плотности потока теплоты, диффузионного потока и ту часть тензора напряжений, которая связана с неравновесными процессами (т.е. через тензор вязких напряжений 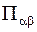 ).
).
Энтропия (в отличие от массы, энергии и импульса) не сохраняется, а возрастает со временем в элементе объёма вследствие необратимых процессов. Положительность скорости изменения энтропии ( 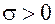 ) выражает в термодинамике необратимых процессов закон возрастания энтропии.
) выражает в термодинамике необратимых процессов закон возрастания энтропии.
Определяется скорость изменения энтропии s только необратимыми процессами (например, диффузией, теплопроводностью, вязкостью) и равна
 , (14.6)
, (14.6)
где 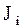 - потоки (диффузионный поток -
- потоки (диффузионный поток -  , тепловой поток -
, тепловой поток - 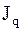 ,тензор вязких напряжений -
,тензор вязких напряжений - 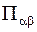 );
);
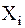 - сопряжённые им термодинамические силы, т.е. градиенты термодинамических параметров, вызывающие отклонение от равновесного состояния.
- сопряжённые им термодинамические силы, т.е. градиенты термодинамических параметров, вызывающие отклонение от равновесного состояния.
В термодинамике равновесных процессов понятие энтропии вводится как термодинамический потенциал. Если переход из одного равновесного состояния системы в другое необратим, то на участках внутри перехода рассматривать изменение энтропии как полный дифференциал уже нельзя. Можно, однако, по-прежнему найти полное изменение энтропии как разность ее значений в начале перехода системы из одного состояния в другое и в конце этого перехода.
Рассмотрим следующий простой пример. Имеется замкнутый сосуд, разделенный пополам перегородкой, не пропускающей газ, но хорошо проводящей тепло (это может быть тонкая медная фольга). Пусть в каждой половине сосуда находятся одинаковые количества одного и того же газа (идеального), но в начальный момент при разных температурах Т1 и Т2, причем Т1>Т2. Так как обе порции газа находятся в тепловом контакте, то через некоторое время температура газа в обеих половинах сосуда выравнивается и станет равной Т3, причем T1>Т3>Т2, т.е. горячий газ охладится, а холодный нагреется. Этот результат хорошо известен. Посмотрим, как в этом случае изменится энтропия всей системы. Пусть число молекул в каждом из смежных объемов одно и то же (N), а число степеней свободы каждой молекулы равно 3 (простейший случай). Тогда, так как на каждую молекулу в среднем приходится энергия 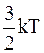 (k-постоянная Больцмана), общий запас энергии в начальный момент Е=
(k-постоянная Больцмана), общий запас энергии в начальный момент Е= 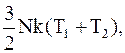 а после установления теплового равновесия соответственно Е=3NkT3.
а после установления теплового равновесия соответственно Е=3NkT3.
Так как система замкнута, то по закону сохранения энергии
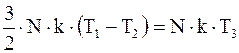 ,
,
откуда
T3=(T1+T2)/2.
Воспользовавшись формулой для изменения энтропии при изменении объема и температуры газа. Так как в данном случае объемы не меняются в процессе эксперимента, а меняется только температура, то изменение энтропии в сумме для двух частей газа в разных половинах сосуда равно
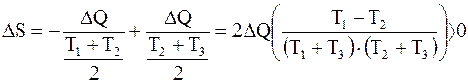 . (14.7)
. (14.7)
В результате получаем, что в целом
 .
.
Таким образом, изменение энтропии в рассматриваемом необратимом процессе положительно.
Рассмотрим второй необратимый процесс. Пусть в сосуде объемом V1 находится одна молекула (рис.14.1).
Уберем перегородку (пунктир), увеличив объем сосуда до V2. Предположим, что мы могли бы сфотографировать молекулу, перемещающуюся в сосуде 1000 раз. Тогда число фотографий, на которых частица будет зафиксирована внутри сосуда (объем V2) будет 1000, т.е. вероятность нахождения ее в сосуде равна 1, в то время как число фотографий, на которых частица зафиксирована в объеме V1 меньше в  раз. Если в сосуде имеется две одинаковые частицы, то вероятность одновременного нахождения ее в меньшем объеме равна произведению вероятностей нахождения каждой из них в объеме V1, т.е.
раз. Если в сосуде имеется две одинаковые частицы, то вероятность одновременного нахождения ее в меньшем объеме равна произведению вероятностей нахождения каждой из них в объеме V1, т.е.  . Следовательно, вероятность нахождения частицы в меньшем объеме в
. Следовательно, вероятность нахождения частицы в меньшем объеме в  раз меньше 1 (вероятности независимых событий перемножаются).
раз меньше 1 (вероятности независимых событий перемножаются).
Если же в сосуде находится N частиц, то вероятность их одновременного нахождения в меньшем объеме в 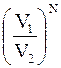 раз меньше вероятности нахождения в большем объеме V2. Итак, число фотографий, на которых все частицы будут равномерно распределены по объему V2, окажется в
раз меньше вероятности нахождения в большем объеме V2. Итак, число фотографий, на которых все частицы будут равномерно распределены по объему V2, окажется в 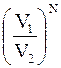 раз больше числа фотографий, на которых все частицы находились бы в меньшем объеме V1. Вероятность микросостояния определяется соотношением
раз больше числа фотографий, на которых все частицы находились бы в меньшем объеме V1. Вероятность микросостояния определяется соотношением
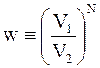 . (14.8)
. (14.8)
Прологарифмируем это выражение (14.8)
 . (14.9)
. (14.9)
Умножим обе части (14.9) на постоянную Больцмана k
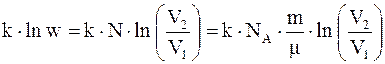 ,
,
где NA - число Авогадро.
В результате получим
 . (14.10)
. (14.10)
Сравнивая (14.10) и (14.9) приходим к выводу, что
 . (14.11)
. (14.11)
Выражение (14.11) носит название формулы Больцмана. Энтропия возрастает с увеличением вероятности макросостояния. В этом заключается статистический смысл энтропии.
Поскольку энтропия замкнутой системы при протекании неравновесных процессов возрастает, то все неравновесные процессы идут в направлении возрастания вероятности макросостояния (т.е. совершается переход к более вероятному макросостоянию).
Вот почему при увеличении объема сосуда происходит расширение газа; тепло переходит от более нагретого тела к менее нагретому. Строго говоря, термодинамика не запрещает полностью и обратный ход процесса. Однако, вероятность его меньше, т.е. практически равна нулю.
В рассмотренных ситуациях процессы необратимые и 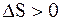 . Данные результаты верны для всех необратимых процессов в замкнутых системах и обобщаются в виде весьма важного утверждения: «Во всех необратимых процессах в замкнутых системах энтропия всегда возрастает!»
. Данные результаты верны для всех необратимых процессов в замкнутых системах и обобщаются в виде весьма важного утверждения: «Во всех необратимых процессах в замкнутых системах энтропия всегда возрастает!»
При этом возрастание энтропии сопровождается и выравниванием (в нашем случае) температур или плотностей газа двух соединяемых объемов. Если под порядком понимать сосредоточение частиц или энергии в определенном месте пространства, а под беспорядком – равномерное распределение их во всем объеме, то возрастание энтропии при совершающихся без внешних воздействий необратимых процессах отражает глубокое природное стремление систем самопроизвольно, если это возможно, переходить от состояния более упорядоченного к состоянию менее упорядоченному.
Закон возрастания энтропии или закон о направлении развития любых спонтанных (самопроизвольных) процессов имеет исключительно значение. Он указывает на существование в природе преимущественного развития сложных статистических систем.
Лекция 15. Реальные газы. Фазовые равновесия и превращения
Реальные газы. Молекулярные силы. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и экспериментальные изотермы реальных газов. Внутренняя энергия реального газа. Эффект Джоуля-Томсона. Фазы и фазовые превращения. Условия равновесия фаз. Фазовые диаграммы. Уравнение Клапейрона-Клаузиуса. Метастабильные состояния. Критическая точка. Тройная точка. Фазовые переходы 1-го и 2-го рода.