 |
|
Законы идеального газа
Состояние некоторой массы газа определяется заданием трех термодинамических параметров – давления р, объёма V и температуры Т. Связь между этими параметрами в общем виде можно выразить формулой F(p, V, T) = 0. Такое соотношение называется уравнением состояния системы (газа).
Простейшими свойствами обладает идеальный газ, т.е. газ, взаимодействием между молекулами которого можно пренебречь. Всякий достаточно разреженный газ близок к идеальному. Воздух, азот, кислород при обычных условиях (1 атм, комнатные температуры) мало отличаются от идеального газа.
Уравнение состояния идеального газа может быть записано в виде объединённого газового закона:
 . (3)
. (3)
Закон Авогадро: одинаковое количество молей любого газа при одинаковых температуре и давлении занимают одинаковые объёмы. В частности, при нормальных условиях: Т0 = 273,15 K,
р0 = 1 атм = 760 мм рт. ст. = 101325 Паобъём 1 моля равен VМ = 22,4 л. Отсюда следует, что, если любого газа взять 1 моль, то величина константы в уравнении (3) будет одинакова для всех газов. Обозначим её буквой R и назовем универсальной газовой постоянной:
 .
.
Перепишем последнее уравнение в виде pVM = RT.
Умножим его на произвольное число молей n: pVMn = nRT.
Учтем, что VM n = V и n = m/M (где m – масса газа, а М – молярная масса), и получим уравнение Менделеева-Клапейрона (уравнение состояния для произвольной массы газа):
 . (4)
. (4)
Умножим и разделим правую часть уравнения Менделеева- Клапейрона (4) на число Авогадро NА:
 .
.
Произведение nNA равно общему числу молекул N, а отношение R/NA является постоянной Больцмана k. Итак, имеем:
pV= NkT, или  , (5)
, (5)
где n – концентрация частиц.
Изопроцессами называются термодинамические процессы, происходящие в системе при постоянной массе и каком-либо одном постоянном параметре состояния – p, V или T.
Пусть р0 и V0 – это давление и объём газа при 0 °С.
Изотермическийпроцесс (закон Бойля-Мариотта):
Т = const, pV = const.
Изобарный процесс (закон Гей-Люссака):
p = const, V/T = const или V = V0 (1 + at),
где a = 1/273,15 K-1 – коэффициент объёмного расширения. Если вместо температуры по шкале Цельсия t в последнее уравнение подставить температуру по шкале Кельвина(t = T - 273,15), то можно получить формулу V = V0 aT.
Изохорный процесс (закон Шарля, 2-й закон Гей-Люссака):
V = const, p/T = const или p = p0 (1 + at),
где a = 1/273,15 K-1 – термический коэффициент давления. Если в это уравнение вместо температуры по шкале Цельсия t подставить температуру по шкале Кельвина (t = T - 273,15), то после преобразований получим p = p0 aT.
Графики изопроцессов представлены на рис. 2.
 |
 Предположим, что в сосуде находится в тепловом равновесии смесь газов, химически не реагирующих между собой. Пусть N – общее число молекул в сосуде, а N1, N2 … – количества молекул компонент смеси. Найдем давление этой смеси:
Предположим, что в сосуде находится в тепловом равновесии смесь газов, химически не реагирующих между собой. Пусть N – общее число молекул в сосуде, а N1, N2 … – количества молекул компонент смеси. Найдем давление этой смеси:


= n1 k T + n2 k T + … = 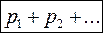 , (6)
, (6)
где p1,р2 … – парциáльные давления компонент смеси. Формула (6) показывает, что каждая группа молекул оказывает давление, не зависящее от других молекул. Поэтому можно сформулировать закон Дальтона: давление смеси химически не взаимодействующих газов равно сумме парциальных давлений.
Найдем молярную массу смеси.
Масса смеси равна mС = m1 + m2 +…
Число частиц в смеси равно NC = N1 + N2 + …
Найдем число частиц N, используя формулу N = NAn:

Отсюда находим молярную массу смеси:
 . (7)
. (7)