 |
|
Распределение Максвелла
Пусть имеется N молекул, находящихся в тепловом движении. Их скорости хаотически меняют величину и направление. Мáксвелл показал, что, несмотря на хаотичность, существует строго определенное и однозначное распределение скоростей между молекулами.
Отложим на оси скорости все возможные скорости молекул (рис. 9). Найдем количество молекул DN, скорости которых заключены в интервале [υ, υ + Dυ]. Очевидно, это количество DN будет пропорционально общему числу молекул N, размеру интервала скорости Dυ и функции распределения молекул по скоростям F(υ):
 , или
, или  , или
, или  .
.
 Физический смысл F(υ): при Dυ = 1 функция F(υ) = DN/N - доля частиц от общего числа, скорости которых заключены в единичном интервале вблизи скорости υ.
Физический смысл F(υ): при Dυ = 1 функция F(υ) = DN/N - доля частиц от общего числа, скорости которых заключены в единичном интервале вблизи скорости υ.
Условие нормировки:  , т.е. число частиц, имеющих скорости в интервале [0, ¥], равно N (а N/N = 1).
, т.е. число частиц, имеющих скорости в интервале [0, ¥], равно N (а N/N = 1).
Одна из форм записи функции распределения Максвелла имеет вид

 , (19)
, (19)
где υ – скорость на длине свободного пробега; m – масса одной молекулы; k – постоянная Больцмана; Т – температура.
График функции F(υ) показан на рис. 10. Как и следовало ожидать, F(υ) = 0 при υ = 0 и υ = ¥, т.е. в газе нет неподвижных молекул и движущихся с бесконечно большими скоростями.
Найдем наиболее вероятную скорость υВЕР, определяющую максимум кривой распределения. Для этого следует взять производную и приравнять её к нулю (постоянные множители при этом вынесутся за знак производной):
 ,
,
 ,
,
 .
.
Корнями последнего уравнения будут
 ,
,  ,
,  .
.
Первые два корня – это минимумы функции F(υ), а третий корень – максимум (наиболее вероятная скорость):
 . (20)
. (20)
Найдем значение функции распределения в максимуме, подставив формулу (20) в уравнение (19):
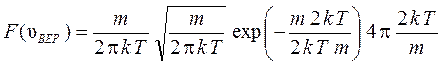 ,
,
 . (21)
. (21)
Из формул (20) и (21) следует, что при увеличении температуры или уменьшении массы молекулы максимум кривой смещается вправо и становится ниже (рис. 11). Однако площадь под кривой из условия нормировки (S = 1) сохраняется.
Зная функцию распределения F(υ), можно найти среднюю (арифметическую) скорость:

 . (22)
. (22)
Так, например, для T = 300 К средние скорости молекул кислорода и водорода равны соответственно 445 м/с и 1782 м/с.
Функции F(υ) можно придать другой вид, удобный при расчетах, если ввести относительную скорость: u = υ/υBEP.
Тогда  ,
,  .
.
Если подставить получившиеся выражения для υ и dυв формулу dN/N = F(υ) d υ, то можно получить функцию распределения F(u) для относительной скорости:
 ,
,

 , где
, где 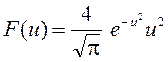 . (23)
. (23)
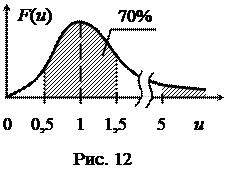
У 70% всех молекул скорость отличается от наиболее вероятной не более чем на 50% (рис. 12). А скорости, превышающие наиболее вероятную более чем в 5 раз, наблюдаются у одной из 12 млрд молекул.
 Распределение Максвелла позволяет объяснить существование и рассеяние атмосферы планет. Чтобы покинуть Землю, молекула должна иметь скорость, превышающую вторую космическую (11,2 км/с). Эта скорость в 25 раз превышает наиболее вероятную скорость для молекул кислорода. Поэтому число покинувших Землю молекул кислорода очень мало. Однако легкие газы (водород, гелий) в основном рассеялись и остались «тяжелые» газы с небольшой скоростью молекул (азот, кислород, аргон, углекислый газ). Атмосферы сохранились у тех планет, у которых сильное тяготение (высокая вторая космическая скорость) и низкая температура (низкая скорость самих молекул). Атмосферы состоят в основном из «тяжелых» газов – азот, кислород, аммиак, метан и т.п.
Распределение Максвелла позволяет объяснить существование и рассеяние атмосферы планет. Чтобы покинуть Землю, молекула должна иметь скорость, превышающую вторую космическую (11,2 км/с). Эта скорость в 25 раз превышает наиболее вероятную скорость для молекул кислорода. Поэтому число покинувших Землю молекул кислорода очень мало. Однако легкие газы (водород, гелий) в основном рассеялись и остались «тяжелые» газы с небольшой скоростью молекул (азот, кислород, аргон, углекислый газ). Атмосферы сохранились у тех планет, у которых сильное тяготение (высокая вторая космическая скорость) и низкая температура (низкая скорость самих молекул). Атмосферы состоят в основном из «тяжелых» газов – азот, кислород, аммиак, метан и т.п.