 |
|
Статистический и термодинамический методы.
Статистический и термодинамический методы исследования.Молекулярная физика и термодинамика — разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в них атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (молекулярно-кинетический) и термодинамический. Первый лежит в основе молекулярной физики, второй — термодинамики.
Молекулярная физика — раздел физики, в котором изучаются строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Идея об атомном строении вещества высказана древнегреческим философом Демокритом (460 — 370 до п. э.). Атомистика возрождается вновь лишь в XVII в.
и развивается в работах М.В.Ломоносова, взгляды которого на строение вещества и тепловые явления были близки к современным. Строгое развитие молекулярной теории относится к середине XIX в. и связано с работами немецкого физика Р.Клаузиуса (1822 —1888), Дж. Максвелла и Л.Больцмана.
Процессы, изучаемые молекулярной физикой, являются результатом совокупного действия огромного числа молекул. Законы поведения огромного числа молекул, являясь статистическими закономерностями, изучаются с помощью статистического метода.
Этот метод основан на том, что свойства макроскопической системы в конечном счете определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии и т.д.) Например,температура тела определяется скоростью хаотического движения его молекул, но так как в любой момент времени разные молекулы имеют различные
скорости, то она может быть выражена только через среднее значение скорости движения молекул. Нельзя говорить о температуре одной молекулы. Таким
образом, макроскопические характеристики тел имеют физический смысл лишь в случае большого числа молекул.
Термодинамика — раздел физики, в котором изучаются общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамика не рассматривает микропроцессы,
которые лежат в основе этих превращений. Этим термодинамический метод отличается от статистического. Термодинамика базируется на двух началах —фундаментальных законах, установлен-
ных в результате обобщения опыта.
Количество вещества —физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которыхсостоит вещество (атомы,молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в СИ — моль.
Конста́нта Авогадро — физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества.
NA = 6,02214129(27)×1023 моль−1.
Моля́рная ма́сса вещества — масса одного моля вещества.
Вмолекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал посравнению собъемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой исо стенками сосуда абсолютно упругие.
Закон Бойля — Мариотта1: 
Законы Гей-Люссака2:1) объем данной массы газа при постоянном давлении изменяется линейно с температурой:
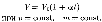
2) давление данной массы газа при постоянном объеме изменяется линей но с температурой: 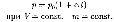
В этих уравнениях t — температура по шкале Цельсия, р0 и Vo — давление и объем при 0°С, коэффициент а = 1/273,15 К- 1
Процесс, протекающий при постоянном давлении, называется изобарным. На диаграмме в координатах V, t
(рис. 63) этот процесс изображается прямой, называемой изобарой. Процесс, протекающий при постоянном объеме,
называется изохорным. На диаграмме в координатах р, t (рис. 64) он изображается прямой, называемой изохорой. 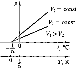
Закон Авогадрох\ 1 моль любого газа при одинаковых температуре и давлении занимает одинаковый объем. При
нормальных условиях этот объем равен 22,41 • 1СГ3 м3/моль.
По определению, 1 моль различных веществ содержит одно и то же число молекул, называемое постоянной Аво-
гадро: 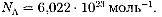
Закон Дальтона2: давление смеси идеальных газов равно сумме парциальных давлений р1: р2, ..., рп входящих в
нее газов: P = Pl + P2 + ...+ Рп-
Парциальное давление — давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один
занимал объем, равный объему смеси при той же температуре.