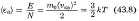|
|
Давления газа на стенку сосуда.
Для вывода основного уравнения молекулярно-кинетической теории рассмотрим одноатомный идеальный газ. Молекулы газа движутся хаотически, число взаимных столкновений между молекулами газа пренебрежимо мало по сравнению с числом ударов о стенкисосуда, а соударения молекул со стенками сосуда абсолютно упругие. Выделим на стенке сосуда некоторую элементарную площадку AS1 (рис. 66) и вычислим давление, оказываемое на эту площадку. При каждом соударении молекула, дви-

жущаяся перпендикулярно площадке, передает ей импульс 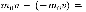
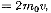 где
где 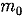 —масса молекулы, v —ее скорость. Завремя
—масса молекулы, v —ее скорость. Завремя  площадки
площадки 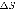 достигнут только те молекулы, которые заключены в объеме цилиндра с основанием
достигнут только те молекулы, которые заключены в объеме цилиндра с основанием 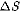 и высотой
и высотой 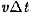 . Число этих молекул равно
. Число этих молекул равно 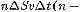 концентрация молекул).
концентрация молекул).
Необходимо, однако, учитывать, что реально молекулы движутся к площадке 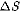 ,под разными углами, имеют раз
,под разными углами, имеют раз
личные скорости, причем скорость молекул при каждом соударении меняется. Для упрощения расчетов хаотиче-
ское движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлений, так что в лю-
бой момент времени вдоль каждого из них движется 1/3молекул, причем из них половина (l/б) движется вдоль дан-
ного направления в одну сторону, половина —в противоположную. Тогда число ударов молекул, движущихся в заданном направлении, оплощадку 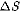 будет
будет  При столкновении с
При столкновении с
площадкой эти молекулы передадут ей импульс 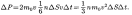
Тогда давление газа, оказываемое им на стенку сосуда,  Если газ в объеме V содержит N мо-
Если газ в объеме V содержит N мо-
лекул, движущихся со скоростями уъ г>2,..., vN, то целесообразно рассматривать среднюю квадратичную скорость  характеризующую всю совокупность
характеризующую всю совокупность
молекул газа. Уравнение (43.1) с учетом (43.2) примет вид 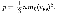 Выражение (43.3) называется ос-
Выражение (43.3) называется ос-
новным уравнением молекулярно-кинетической теории идеальных газов. Точный расчет с учетом движения мо-
лекул по всевозможным направлениямдает ту же формулу.
Учитывая, что п = 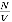 , получим
, получим  или
или 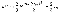 где Е —суммарная кинетическая энергия поступательного движения всех молекул газа. Так как масса газа
где Е —суммарная кинетическая энергия поступательного движения всех молекул газа. Так как масса газа 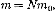 то урав
то урав
нение (43.4) можно переписать в виде 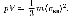
Для 1моль газа т= М(М— молярная масса), поэтому  где —молярный объем. Сдругой стороны, поуравнению Клапейрона —Менделеева,
где —молярный объем. Сдругой стороны, поуравнению Клапейрона —Менделеева,  Таким образом,
Таким образом, 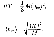
Так как  — масса одной молекулы, a NA — постоянная Авогадро, то из уравнения (43.6) следует,
— масса одной молекулы, a NA — постоянная Авогадро, то из уравнения (43.6) следует,
что 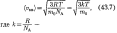 постоянная Больцмана.
постоянная Больцмана.
Отсюда найдем, что при комнатной температуре молекулы кислорода имеют среднюю квадратичную скорость 480 м/с, водорода — 1900 м/с. При температуре жидкого гелия те же скоростибудут соответственно 40 и 160 м/с. Средняя кинетическая энергия поступательного движения одной молекулы идеального газа