 |
|
СПОСОБИ ВИРАЖЕННЯ КІЛЬКІСНОГО СКЛАДУ РОЗЧИНУ
Розчини. Способи вираження складу розчинів.



СПОСОБИ ВИРАЖЕННЯ КІЛЬКІСНОГО СКЛАДУ РОЗЧИНУ
Розчини — речовини змінного складу. Природно, що від кількісного складу розчину залежать його властивості, тому при описі властивостей розчину необхідно вказувати його склад.
Склад розчину характеризують відносним вмістом у ньому розчиненої речовини. Прийнято виражати склад розчинів через частки або концентрації.
Частка показує відношення маси, об’єму або кількості (виражене в молях) розчиненої речовини до сумарної маси, об’єму або суми кількостей речовин усіх компонентів розчину.
Масова частка розчиненої речовини — це відношення його маси m до маси розчину mp. Її прийнято позначати латинською літероюw (дубль-ве):

Ця величина виражається в частках одиниці або у відсотках.
У лабораторній практиці часто використовують молярну концентрацію. Молярна концентрація — це відношення кількості розчиненої речовини ν (в молях) до об’єму розчину V (в літрах). Її прийнято позначати літерою С:
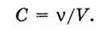
Наприклад, якщо 1 л розчину сульфатної кислоти містить 2 моль Н2SO4, то це означає, що молярна концентрація дорівнює 2 моль/л. Такий розчин називають двомолярним і позначають так: 2М Н2SO4. Запис 0,1 М розчин NаСl означає, що віл розчину міститься 0,1 моль NаСl. Такий розчин називають децимолярним.
Склад розчину можна виражати якісно й кількісно. Розчини з відносно низьким вмістом розчиненої речовини називаютьрозведеними, а з відносно високим — концентрованими. Якісна оцінка досить умовна, бо для розчинів різних речовин ці поняття мають свої обмеження. Кількісний склад розчину визначається концентрацією.
Концентрація — це безрозмірна або розмірна величина, яка виражає співвідношення компонентів у системі. Для системи, що складається з розчинника та розчиненої речовини, концентрацією (не розчину, а розчиненої речовини) називають кількість розчиненої речовини, що міститься в певній кількості розчину або розчинника. Найчастіше застосовують такі способи вираження концентрації:
1. Молярна частка — відношення кількості даного компонента до загальної кількості всіх компонентів розчину:
де ni— кількість i-го компонента (у молях).
Аналогічно визначають масову та об'ємну частки.
Масова (об'ємна) частка — відношення маси (об'єму) розчиненої речовини до загальної маси (об'єму) розчину:
де т1 і m2 — маси, а V1 i V2 — об'єми розчиненої речовини та розчинника.
2. Молярність розчину — величина, що чисельно дорівнює молярній концентрації розчиненої речовини. Молярна концентрація — це відношення кількості розчиненої речовини до об'єму розчину V (у літрах):
Розчини однакової молярності (еквімолярні) реагують між собою в об'ємах, пропорційних стехіометричним коефіцієнтам у рівнянні реакції.
4. Моляльність розчину (моляльна концентрація) визначається відношенням кількості розчиненої речовини до маси розчинника (а не розчину!) в кілограмах:
5.
де m2/1000 — маса розчинника в кілограмах. Моляльність розчину, на відміну від його молярності, не залежить від температури.
4. Нормальність розчину — величина, що чисельно дорівнює молярній концентрації еквівалентів. Виражається відношенням еквівалентної кількості розчиненої речовини до об'єму розчину в літрах:
де Ет — молярна маса еквівалента розчиненої речовини.
Розчини однакової нормальності реагують у однакових об'ємах. У разі неоднакових нормальностей розчинів останні взаємодіють в об'ємах, обернено пропорційних їхнім нормальностям:
Нормальність і молярність розчинів збігаються для однокис-лотних основ та одноосновних кислот.
Молярну концентрацію еквівалентів розчиненої речовини можна уявити як відношення молярної концентрації до фактора еквівалентності fе цієї речовини в конкретній реакції Се = См/fе.
5. Титр — відношення маси розчиненої речовини в грамах до об'єму розчину в мілілітрах:
Розчин кожної речовини має певну густину р (г/мл, або кг/л), яку враховують при переході від масових концентрацій до об'ємних, і навпаки.