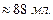|
|
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
РАСТВОРЫ. ДИСПЕРСНЫЕ СИСТЕМЫ
Утверждено Редакционно-издательским советом университета
в качестве учебного пособия
Магнитогорск, 2011 г.
УДК 54
Рецензенты:
Заведующий кафедрой «Химическая технология»
Южно-Уральского государственного университета
доктор технических наук, старший научный сотрудник
Б.Ш. Дыскина
Доцент Магнитогорского Государственного университета,
кандидат химических наук,
В.А. Дозоров
Варламова И.А., Коляда Л.Г.
Растворы. Дисперсные системы: Учеб. пособие.-Магнитогорск: ГОУ ВПО «МГТУ», 2011.- с.
ISBN
Пособие предназначено для студентов технических специальностей, изучающих дисциплины «Химия», «Общая химия» и «Неорганическая химия». Пособие включает в себя задачи по разделам курса химии: растворы и дисперсные системы (способы выражения концентрации растворов, свойства разбавленных растворов неэлектролитов, растворы электролитов, комплексные соединения, коллоидно-дисперсные системы).
В пособии приводятся краткие теоретические сведения по каждой теме, примеры решения типовых задач и многовариантные контрольные задания для самостоятельного решения. Пособие также включает справочный материал.
УДК 54
ISBN © ГОУ ВПО «МГТУ», 2011
·© Варламова И.А., Коляда Л.Г., 2011
ОГЛАВЛЕНИЕ
| Предисловие…………………………………………………………... | |
| Введение……………………………………………………………….. | |
| 1.Способы выражения концентрации растворов………………... | |
| Контрольные задания для самостоятельной работы…………... | |
| 2.Свойства разбавленных растворов неэлектролитов………… | |
| 2.1.Осмос. Осмотическое давление………………………………. | |
| Контрольные задания для самостоятельной работы…………... | |
| 2.2. Давление насыщенного пара растворителя над раствором. Первый закон Рауля…………………………………………… | |
| Контрольные задания для самостоятельной работы………….. | |
| 2.3. Температура замерзания и кипения растворов. Второй закон Рауля……………………………………………………………. | |
| Контрольные задания для самостоятельной работы…………... | |
| 3.Растворы электролитов…………………………………………… | |
| 3.1. Степень диссоциации. Константа диссоциации слабого электролита……………………………………………………………. | |
| 3.1.1. Вычисление концентрации ионов и степени диссоциации слабого электролита……………………..…….………………. | |
| 3.1.2. Вычисление константы диссоциации слабого электролита…………………………...………………………………….……... | |
| 3.1.3. Вычисления, связанные со смещением равновесия диссоциации слабого электролита…………………………….….. | |
| Контрольные задания для самостоятельной работы…………… | |
| 3.2.Сильные электролиты. Активность. Ионная сила……..…… | |
| Контрольные задания для самостоятельной работы…………… | |
| 3.3.Сильные электролиты. Изотонический коэффициент……… | |
| Контрольные задания для самостоятельной работы…………… | |
| 3.4.Реакции ионного обмена………………………………………… | |
| 3.4.1.Составление ионно-молекулярных уравнений……………. | |
| 3.4.2.Составление молекулярных уравнений по ионно-молекулярным…………………………………………………………. | |
| Контрольные задания для самостоятельной работы…………… | |
| 3.5.Диссоциация воды. Водородный показатель……………..… | |
| 3.5.1.Ионное произведение воды…………………………………... | |
| 3.5.2.Водородный показатель………………………………………. | |
| 3.5.3.Примеры решения задач……………………………………… | |
| Контрольные задания для самостоятельной работы…………… | |
| 3.6.Гидролиз солей……………………………………………………. | |
| 3.6.1. Количественные характеристики процесса гидролиза….. | |
| 3.6.2. Примеры решения задач……………………………………... | |
| Контрольные задания для самостоятельной работы…………… | |
| 3.7.Произведение растворимости………………………………….. | |
| Контрольные задания для самостоятельной работы…………… | |
| 4.Комплексные соединения…………………………………………. | |
| 4.1.Основные положения координационной теории…………….. | |
| 4.2.Номенклатура комплексных соединений……………………... | |
| 4.3.Природа химической связи в комплексных соединениях….. | |
| 4.4.Классификация комплексных соединений…………………. | |
| 4.5.Образование комплексных соединений………………………. | |
| 4.6.Диссоциация комплексных соединений……….……………… | |
| 4.7.Примеры решения задач………………………………………… | |
| Контрольные задания для самостоятельной работы…………… | |
| 5.Коллоидно-дисперсные системы………………………………. | |
| 5.1.Классификация коллоидных систем………………………..… | |
| 5.2.Получение коллоидных систем………………………………… | |
| 5.3.Строение коллоидных частиц…………………………………... | |
| 5.4.Устойчивость коллоидных систем………………………..…… | |
| 5.5.Примеры решения задач………………………………………… | |
| Контрольные задания для самостоятельной работы…………… | |
| Приложение…………………………………………………………….. | |
| Библиографический список………………………………………….. |
ПРЕДИСЛОВИЕ
Учебное пособие написано в соответствии с требованиями Государственных образовательных стандартов высшего профессионального образования и программами учебных курсов «Химия», «Общая химия» и «Неорганическая химия» для технических специальностей вузов.
Предлагаемое учебное пособие разработано в дополнение к учебнику и соответствует нескольким разделам программы учебного курса по химии (растворы, дисперсные системы). При изучении курса химии большое значение имеет приобретение навыков в решении задач, что является одним из критериев прочного усвоения курса.
Каждая глава содержит теоретический материал, примеры решения типовых задач и контрольные задания для самостоятельного решения. В первой главе рассмотрены способы выражения количественного состава растворов. Во второй главе представлены коллигативные свойства разбавленных растворов неэлектролитов (осмотическое давление, давление пара растворителя над раствором, температуры кипения и кристаллизации растворов неэлектролитов). Третья глава посвящена свойствам растворов электролитов, закономерностям процессов диссоциации, реакциям в растворах электролитов, в том числе процессам гидролиза солей, расчетам, связанным с определением рН растворов и произведений растворимости малорастворимых соединений. В четвертой главе рассмотрены основы химии координационных соединений, а в пятой – процессы образования, свойства и устойчивость дисперсных систем, в том числе коллоидных растворов, имеющих большое значение в различных технологических процессах.
Справочный материал, необходимый для решения задач, приводится в Приложении. В пособии использовалась, главным образом, Международная система единиц (СИ). Однако, в ряде случаев использовались нестандартные единицы (например, литр), которые часто встречаются в учебной и технической литературе.
ВВЕДЕНИЕ
Очень многие химические реакции, в том числе технически и жизненно важные, протекают в жидких системах. Раствор - это гомогенная (однофазная) система переменного состава (в зависимости от температуры, давления и других условий), в которой одно или несколько веществ равномерно распределены в среде другого вещества. Поэтому растворы могут состоять из двух и более компонентов, которые распределяются в виде атомов, молекул, ионов или в виде групп (ассоциатов) небольшого числа этих частиц. То вещество, которое растворяет другое, называется растворителем. Растворитель в чистом виде существует в том же агрегатном состоянии, что и образовавшийся раствор. Любой раствор состоит из растворителя и одного или нескольких растворенных веществ.
Растворы могут иметь любое агрегатное состояние: твердое (растворы металлов), жидкое (растворы твердых, жидких, газообразных веществ в жидкостях), газообразное (смеси газов). В зависимости от природы растворителя растворы бывают водными и неводными. В зависимости от природы растворенного вещества различают растворы электролитов и неэлектролитов.
Важнейшей характеристикой раствора является его состав, который выражается концентрациями компонентов. В зависимости от концентрации жидкого раствора говорят о разбавленных и концентрированных растворах. Большое значение для химии и технологии имеют способы выражения количественного состава растворов.
Истинные растворы представляют гомогенную смесь компонентов, в которых размеры молекул, атомов или ионов обычно не превышают 5·10-9 м. При увеличении размеров частиц система становится гетерогенной, состоящей из двух или более фаз с сильно развитой поверхностью раздела. Такие системы получили название дисперсных систем. Типичными дисперсными (коллоидными) системами являются золи, в которых дисперсной фазой является твердое тело, а дисперсионной средой – жидкость.
Координационные или комплексные соединения - соединения определенного состава, образующиеся в результате координации ионов или нейтральных молекул (лигандов) атомом или ионом химического элемента (комплексообразователем) по донорно-акцепторному механизму. Реакционная способность комплексных соединений определяется скоростью обмена лигандов на другие ионы или молекулы в растворе.
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Концентрацией называют количественную характеристику раствора, определяющую относительное содержание в нём растворённого вещества и растворителя.
В химии общеприняты следующие способы выражения концентрации растворенного вещества в растворах:
1) массовая доля растворённого вещества;
2) молярная концентрация растворённого вещества;
3) молярная концентрация эквивалентов растворённого вещества;
4) моляльная концентрация растворённого вещества;
5) титр;
6) мольная доля растворённого вещества.
Массовая доля растворённого вещества  (символ -
(символ -  , безразмерная величина, выражается в долях единицы или процентах) - показывает, какую часть массы всего раствора составляет масса растворённого вещества.
, безразмерная величина, выражается в долях единицы или процентах) - показывает, какую часть массы всего раствора составляет масса растворённого вещества.
Массовую долю  находят как отношение массы растворенного вещества
находят как отношение массы растворенного вещества 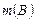 к массе всего раствора
к массе всего раствора  :
:
 =
=  (в долях единицы);
(в долях единицы);
 =
=  (в процентах).
(в процентах).
Массу раствора  можно найти, зная объём раствора
можно найти, зная объём раствора  (мл) и его плотность
(мл) и его плотность  (г/мл):
(г/мл):
 ,
,
или, зная для раствора массу растворённого вещества 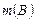 и массу растворителя
и массу растворителя  :
:
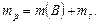
Пример 1. Раствор хлорида железа (III) объёмом 200 мл и плотностью 1,015 г/мл содержит 4,06 г  . Определите массовую долю
. Определите массовую долю  в растворе.
в растворе.
Дано: Решение:

 = 200 мл 1. Найдём массу раствора:
= 200 мл 1. Найдём массу раствора:
 = 1,015 г/мл
= 1,015 г/мл  = 1,015·200=203,00 г.
= 1,015·200=203,00 г.

 = 4,06 г 2. Найдём массовую долю
= 4,06 г 2. Найдём массовую долю  :
:

 4,06/203,00=0,02.
4,06/203,00=0,02.
Ответ:  = 0,02 (2%).
= 0,02 (2%).
Молярная концентрация растворённого вещества  - молярность - показывает, какое количество растворённого вещества содержится в 1 л раствора (символ -
- молярность - показывает, какое количество растворённого вещества содержится в 1 л раствора (символ -  ; размерность - моль/л).
; размерность - моль/л).
Молярную концентрацию  рассчитывают как отношение количества растворённого вещества
рассчитывают как отношение количества растворённого вещества  (моль) в растворе к объёму
(моль) в растворе к объёму  (л) этого раствора:
(л) этого раствора:
 .
.
Количество растворённого вещества  находят, зная массу растворённого вещества
находят, зная массу растворённого вещества 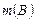 (г) и молярную массу растворённого вещества
(г) и молярную массу растворённого вещества  (г/моль):
(г/моль):
 (моль).
(моль).
Сокращённая форма записи единицы молярной концентрации:  ≡ моль/л. Например, 2
≡ моль/л. Например, 2  раствор - двумолярный раствор – это раствор, в 1л которого содержится 2 моль растворённого вещества, т.е.
раствор - двумолярный раствор – это раствор, в 1л которого содержится 2 моль растворённого вещества, т.е.  = 2 моль/л.
= 2 моль/л.
Пример 2. Рассчитайте массу растворённого вещества в
300 мл 1,36  раствора сульфата меди (II).
раствора сульфата меди (II).
 Дано: Решение:
Дано: Решение:
 = 300 мл = 0,3 л 1. Найдем количество сульфата меди (II)
= 300 мл = 0,3 л 1. Найдем количество сульфата меди (II)  =1,36 моль/л в 300 мл 1,36
=1,36 моль/л в 300 мл 1,36  раствора:
раствора:

 - ?
- ? 
2. Рассчитаем молярную массу вещества:
 .
.
3. Рассчитаем массу вещества:

Ответ: 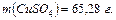
Молярная концентрация эквивалентов вещества  - нормальность, нормальная или эквивалентная концентрация - показывает, какое количество эквивалентов растворённого вещества
- нормальность, нормальная или эквивалентная концентрация - показывает, какое количество эквивалентов растворённого вещества  содержится в 1 л раствора (символ –
содержится в 1 л раствора (символ –  , размерность – моль/л; сокращённое обозначение единицы -
, размерность – моль/л; сокращённое обозначение единицы - 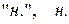 ≡ моль/л).
≡ моль/л).
Молярная концентрация эквивалентов вещества  - отношение количества эквивалентов вещества к объему раствора (л):
- отношение количества эквивалентов вещества к объему раствора (л):
 .
.
Количество эквивалентов вещества рассчитывают как отношение его массы к молярной массе эквивалентов:
 .
.
Молярная масса эквивалентов вещества  - масса одного моля эквивалентов этого вещества, равная произведению фактора эквивалентности
- масса одного моля эквивалентов этого вещества, равная произведению фактора эквивалентности 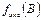 на молярную массу вещества
на молярную массу вещества  :
:
 .
.
В реакциях ионного обмена, протекающих с участием кислот и оснований, фактор эквивалентности вычисляется с учетом числа вступающих в реакцию катионов водорода кислоты или ионов гидроксила основания, т. е.  находят по формуле
находят по формуле  , где
, где  - число катионов водорода
- число катионов водорода 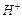 или число гидроксильных групп
или число гидроксильных групп  , участвующих в кислотно-основной реакции.
, участвующих в кислотно-основной реакции.
Например, в реакциях, выражаемых уравнениями:

молярная масса эквивалентов ортофосфорной кислоты и гидроксида натрия равна их молярной массе  , т.к. в реакции участвует один катион
, т.к. в реакции участвует один катион 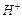 и одна группа
и одна группа  :
:
 ;
;
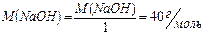 .
.
Молярная масса эквивалентов гидроксида алюминия и серной кислоты равна  их молярной массы
их молярной массы  из–за участия в реакции двух групп
из–за участия в реакции двух групп  и двух катионов
и двух катионов  :
:
 ;
;
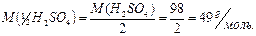
Фактор эквивалентности при вычислении молярной массы эквивалентов соли равен:

Так, молярная масса эквивалентов фосфата кальция равна
 .
.
Массу вещества в растворе находят по формуле:

 . (2.6)
. (2.6)
Молярную концентрацию эквивалентов выражают в тех же единицах, что и молярную концентрацию (в моль/дм3 или в моль/л). Например,  = 0,1 моль/л.
= 0,1 моль/л.
При использовании сокращенного обозначения молярной концентрации эквивалентов (нормальности) 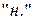 необходимо указать фактор эквивалентности. Например,
необходимо указать фактор эквивалентности. Например, 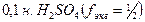 .
.
Использование термина «нормальная концентрация» имеет смысл, когда фактор эквивалентности меньше единицы. В тех случаях, когда  , надо пользоваться термином «молярная концентрация». Например, вместо
, надо пользоваться термином «молярная концентрация». Например, вместо  следует писать
следует писать 
Перевод молярной концентрации эквивалентов в молярную концентрацию и обратно осуществляют по формуле:
 . (2.7)
. (2.7)
 Пример 3. Рассчитайте молярную концентрацию эквивалентов сульфата железа (III) в растворе, полученном при растворении 60 г
Пример 3. Рассчитайте молярную концентрацию эквивалентов сульфата железа (III) в растворе, полученном при растворении 60 г 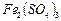 в 240 мл воды. Плотность раствора 1,181 г/мл.
в 240 мл воды. Плотность раствора 1,181 г/мл.
Дано: Решение:
 1. Найдём массу воды:
1. Найдём массу воды:
 т.к.
т.к.  то
то 

 2. Найдём массу раствора:
2. Найдём массу раствора:


3. Найдём объём раствора:

4. Рассчитаем молярную массу эквивалентов 
 ;
;
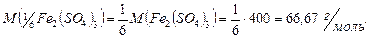
5. Найдём количество эквивалентов вещества в растворе:
 .
.
6. Рассчитаем молярную концентрацию эквивалентов  :
:

Ответ: 3,543 моль/л.
Моляльная концентрация вещества  - моляльность - показывает, какое количество растворённого вещества
- моляльность - показывает, какое количество растворённого вещества  приходит-
приходит-
ся на 1 кг растворителя (символ  ; размерность - моль/кг); сокращенное обозначение единицы –
; размерность - моль/кг); сокращенное обозначение единицы –  ≡ моль/кг.
≡ моль/кг.
Моляльность вещества  -
-  - рассчитывают как отношение количества вещества в растворе
- рассчитывают как отношение количества вещества в растворе  к массе растворителя
к массе растворителя  в этом растворе:
в этом растворе:

Массу растворителя можно найти, зная массу всего раствора  и массу растворённого вещества
и массу растворённого вещества  :
:

Пример 4. Рассчитайте моляльность раствора cульфата железа (III), приведенного в примере 3.
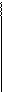 Дано: Решение:
Дано: Решение:
 1. Найдём массу растворителя:
1. Найдём массу растворителя:
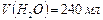 учитывая, что
учитывая, что  находим
находим



 2. Найдём количество
2. Найдём количество 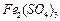 :
:

3. Рассчитаем моляльную концентрацию сульфата железа (III) 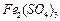 в растворе:
в растворе:
 .
.
Ответ: 0,625 моль/кг.
Титр вещества  это величина, показывающая, сколько граммов растворённого вещества
это величина, показывающая, сколько граммов растворённого вещества  содержится в 1 мл раствора (символ -
содержится в 1 мл раствора (символ -  , размерность - г/мл).
, размерность - г/мл).
Титр 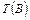 рассчитывают как отношение массы растворенного вещества в растворе
рассчитывают как отношение массы растворенного вещества в растворе  (г) к объёму этого раствора
(г) к объёму этого раствора  (мл):
(мл):

Пример 5. Определите титр гидроксида калия в 11 %-ом растворе КОН. Плотность раствора 1,10 г/мл.
Дано: Решение:

 Пусть
Пусть  масса раствора
масса раствора  тогда по
тогда по

 определению массовой доли
определению массовой доли 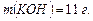
 1. Найдём объём 100 г раствора
1. Найдём объём 100 г раствора

2. Рассчитаем титр КОН:
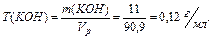
Ответ: 0,12 г/мл.
Мольная доля растворённого вещества  (символ -
(символ -  , безразмерная величина) показывает, какую часть от суммарного количества всех веществ, входящих в состав раствора, составляет количество вещества
, безразмерная величина) показывает, какую часть от суммарного количества всех веществ, входящих в состав раствора, составляет количество вещества  :
:
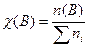 , где
, где  .
.
Пример 6. Рассчитайте мольную долю каждого вещества в
11 %-м растворе КОН.
 Дано: Решение:
Дано: Решение:

 В 100 г раствора масса гидроксида калия
В 100 г раствора масса гидроксида калия

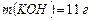 ; масса воды
; масса воды 
1. Найдём молярные массы веществ:

2. Найдём количества веществ в растворе:



3. Рассчитаем мольные доли веществ:
 ,
,
 .
.
Сумма мольных долей всех веществ раствора равна единице
 .
.
Ответ: 
Зная значение одной из концентраций, можно рассчитать все остальные виды концентраций. Для такого пересчёта концентраций необходимо выбрать определённое количество раствора или растворителя. Если известны  ,
,  или
или  , удобнее взять для расчётов 1 л (1000 мл) раствора, для
, удобнее взять для расчётов 1 л (1000 мл) раствора, для  - 100 г раствора, а для
- 100 г раствора, а для  - 1 кг растворителя. Для растворенного вещества следует рассчитать
- 1 кг растворителя. Для растворенного вещества следует рассчитать  для растворителя -
для растворителя -  а для раствора в целом -
а для раствора в целом - 
Пример 7. Плотность  раствора
раствора  равна
равна  . Для растворенного вещества карбоната калия
. Для растворенного вещества карбоната калия  рассчитайте все известные концентрации.
рассчитайте все известные концентрации.
 Дано: Решение:
Дано: Решение:
 Моляльная концентрация
Моляльная концентрация 

 равна
равна  . Тогда на
. Тогда на 

| растворителя приходится 
|

|  , и для пересчёта концентраций , и для пересчёта концентраций
|

| удобно принять массу растворителя |

| 
|

| Количество карбоната калия  по определению моляльной концентрации равно по определению моляльной концентрации равно  . .
|
1. Рассчитаем молярную массу  :
:

2. Рассчитаем молярную массу эквивалентов  :
:

3. Найдём массу растворённого вещества:

4. Найдём количество эквивалентов  в растворе:
в растворе:
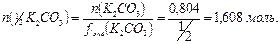
5. Найдём массу раствора:

6. Найдём объем раствора:



7. Определим количество вещества растворителя в растворе:
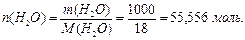
8. Найдём о6щее количество всех веществ в растворе:

Таким образом, мы определили все необходимые для расчетов характеристики:
- для растворённого вещества:
 ;
;
 ;
;
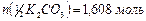 ;
;
- для растворителя:
 ;
;
 ;
;
- для раствора в целом:

 ;
;
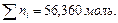
Подставим найденные значения в формулы для расчета концентрации:






Ответ: 





Приготовить водный раствор какого-либо вещества можно в результате одной из следующих операций:
1) растворения безводного вещества в воде;
2) растворения кристаллогидрата в воде;
3) разбавления более концентрированного раствора;
4) смешения растворов разных концентраций и т.д.
Для приготовления раствора заданной концентрации необходимо произвести соответствующие расчёты.
Пример 8. Сколько граммов кристаллогидрата  и воды необходимо взять для приготовления
и воды необходимо взять для приготовления
500 г раствора с массовой долей 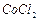 0,13?
0,13?
 Дано: Решение:
Дано: Решение:
 1.Найдём массу
1.Найдём массу 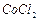 в 500 г 13%-ного
в 500 г 13%-ного

 раствора:
раствора:


 2. Рассчитаем молярную массу
2. Рассчитаем молярную массу  :
:

3. Найдём количество 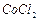 в растворе:
в растворе:

4. Из формулы видно, что при растворении 1 моль кристаллогидрата  образуется 1 моль
образуется 1 моль 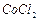 , т.е.
, т.е.
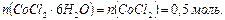
5. Найдём молярную массу кристаллогидрата:

6. Найдём массу  , необходимого для приготовления раствора:
, необходимого для приготовления раствора:

7. Найдём массу воды, необходимой для приготовления раствора:

Ответ: 119 г  и 381 г
и 381 г 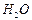 .
.
Пример 9. Сколько миллилитров 96%-го раствора серной кислоты с плотностью 1,84 г/мл потребуется для приготовления
2 л 0,25 М раствора?
 Дано: Решение:
Дано: Решение:
| Имеется раствор: | 1 .Найдём массу серной кислоты, |

| содержащейся в 2 л 0,25 М раствора: |

| 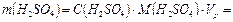
|
| Требуется приготовить раствор: | 
|

| 2. Найдём массу 96%-го раствора, |
 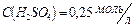
| содержащего столько же растворённого вещества: |

| 
|
3. Найдём объём 96%-го раствора, содержащего 51 г серной кислоты:

Ответ: 28 мл.
Пример 10. Сколько миллилитров концентрированного раствора соляной кислоты с плотностью 1,18 г/мл следует добавить к 500 мл 5 %-го раствора с плотностью 1,025 г/мл, чтобы концентрация  в растворе возросла до 10 %?
в растворе возросла до 10 %?
Дано: Решение:
 1-й раствор: 1-й раствор:
| Для полученного раствора: |

| 
|

| 
|

| 1. Определим для 1-го раствора: a) массу раствора: |
| 2-й раствор: | 
|

| b) массу растворённого вещества: |

| 
|
| Полученный 3-й раствор: | 2. Обозначим объём добавленного (2-го) раствора за 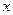
|
 
|  . .
|

| 3. Выразим для 2-го раствора: |
| а) массу раствора: |

b) массу растворённого вещества:

4. Выразим для полученного раствора:
а) массу раствора:
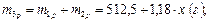
b) массу растворённого вещества:
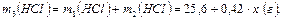
5. Запишем выражение для массовой доли полученного раствора:
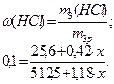
Отсюда, решая уравнение, получаем:  т.е.
т.е. 
Ответ: