 |
|
Примеры решения задач
Пример 41. Золь оксалата серебра  образуется при медленном приливании водного раствора оксалата аммония
образуется при медленном приливании водного раствора оксалата аммония  к водному раствору нитрата серебра
к водному раствору нитрата серебра  . Напишите формулу мицеллы и укажите знак электрического заряда коллоидной частицы этого золя.
. Напишите формулу мицеллы и укажите знак электрического заряда коллоидной частицы этого золя.
Решение:Образование золя  происходит по реакции:
происходит по реакции:
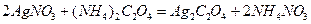 .
.
Строение мицеллы и заряд коллоидной частицы зависят от способа получения коллоидного раствора. Поскольку раствор  взят в избытке, то на поверхности агрегата
взят в избытке, то на поверхности агрегата  будут адсорбироваться ионы
будут адсорбироваться ионы  . Противоионы
. Противоионы  будут образовывать адсорбционный и диффузный слои. Формула мицеллы будет следующая:
будут образовывать адсорбционный и диффузный слои. Формула мицеллы будет следующая:
 .
.
Коллоидная частица приобретает положительный заряд.
Пример 42. Золь гидроксида магния получен путем смешивания 0,02 л 0,01 н. раствора  и 0,028 л 0,005 н. раствора
и 0,028 л 0,005 н. раствора  . Определите заряд частиц полученного золя и напишите формулу его мицеллы.
. Определите заряд частиц полученного золя и напишите формулу его мицеллы.
Решение:При смешивании растворов  и
и  протекает реакция:
протекает реакция:
 .
.
Количество моль-эквивалентов (nэк)  и
и  , участвующих в реакции, определяем по формуле:
, участвующих в реакции, определяем по формуле:
 .
.

 .
.
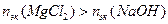 .
.
Из этого следует, что в избытке будет раствор  . Он будет ионным стабилизатором. На ядре коллоидной частицы золя
. Он будет ионным стабилизатором. На ядре коллоидной частицы золя  будут адсорбироваться ионы
будут адсорбироваться ионы  и частица золя приобретет положительный заряд. Противоионами являются ионы
и частица золя приобретет положительный заряд. Противоионами являются ионы 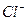 .
.
Формула мицеллы золя гидроксида магния имеет вид:

Пример 43. В каждую из трех колб налито по 0,01 л золя хлорида серебра. Для коагуляции золя в первую колбу добавлено 0,002 л 1М раствора 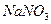 , во вторую - 0,012 л 0,01 М
, во вторую - 0,012 л 0,01 М 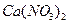 , в третью - 0,007 л 0,001 М
, в третью - 0,007 л 0,001 М  . Вычислите пороги коагуляции электролитов, определите знак заряда частиц золя.
. Вычислите пороги коагуляции электролитов, определите знак заряда частиц золя.
Решение:Порог коагуляции вычисляется по формуле:
 .
.
Вычисляем пороги коагуляции добавляемых электролитов:
 ;
;
 ;
;
 .
.
Добавляемые электролиты содержат анион  и катионы
и катионы 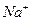 ,
, 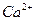 и
и  разной зарядности. Наименьший порог коагуляции у
разной зарядности. Наименьший порог коагуляции у  , следовательно, частицы золя хлорида серебра заряжены отрицательно.
, следовательно, частицы золя хлорида серебра заряжены отрицательно.
Пример 44. Порог коагуляции раствора  для золя гидроксида алюминия, частицы которого заряжены положительно, равен 60,0 ммоль/л. Рассчитайте порог коагуляции
для золя гидроксида алюминия, частицы которого заряжены положительно, равен 60,0 ммоль/л. Рассчитайте порог коагуляции 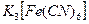 для этого золя.
для этого золя.
Решение:
Коагуляцию золя вызывает тот из ионов прибавленного электролита, заряд которого противоположен заряду коллоидной частицы. Коагулирующая способность иона определяется его зарядом: чем больше заряд иона, тем выше его коагулирующая способность. Значение порогов коагуляции электролитов с одно-, двух- и трехзарядными ионами относятся как числа 729:11:1. Следовательно, порог коагуляции 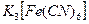 , будет в 729 раз меньше, чем у
, будет в 729 раз меньше, чем у  , т.е.:
, т.е.:
 .
.
КОНТРОЛЬНЫЕ ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Задача 29
Составьте формулу мицеллы золя, полученного путем смешивания растворов  и
и 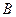 указанных объемов
указанных объемов  и концентраций
и концентраций  .
.
| Вар. | Золь | Раствор А | VА, мл | C, моль/л | Раствор В | VВ, мл | C, моль/л |
| PbSO4 | Pb(NO3)2 | 0,001 н. | K2SO4 | 0,04 М | |||
| AgCl | KCl | 0,02 М | AgNO3 | 0,005 М | |||
| Zn(OH)2 | NaOH | 0,05 М | ZnCl2 | 0,04 н. | |||
| BaSO4 | BaCl2 | 0,002 н. | H2SO4 | 0,005 М | |||
| As2S3 | H2S | 0,06 н. | AsCl3 | 0,001 н. | |||
| Ni(OH)2 | NaOH | 0,001 М | NiCl2 | 0,004 н. | |||
| CuS | CuCl2 | 0,002 н. | H2S | 0,0 М | |||
| AgBr | AgNO3 | 0,008 М | NaBr | 0,009 М | |||
| SrSO4 | Sr(NO3)2 | 0,0005 н. | K2SO4 | 0,004 н. | |||
| Al(OH)3 | AlCl3 | 0,06 н. | NaOH | 0,08 М | |||
| PbCl2 | KCl | 0,05 М | Pb(NO3)2 | 0,01 н. | |||
| CaSO4 | CaCl2 | 0,002 н. | Al2(SO4)2 | 0,01 н. | |||
| H2SiO3 | K2SiO3 | 0,001 М | HCl | 0,05 М | |||
| AgI | AgNO3 | 0,04 М | KI | 0,01 М | |||
| Fe(OH)3 | NaOH | 0,002 н. | Fe2(SO4)3 | 0,0001 н. | |||
| ZnS | ZnCl2 | 0,001 н. | (NH4)2S | 0,003 н. | |||
| PbI2 | KI | 0,0023 М | Pb(NO3)2 | 0,003 н. | |||
| AgCl | HCl | 0,05 М | AgNO3 | 0 004 М | |||
| Hg2SO4 | Hg2(NO3)2 | 0,001 н. | H2SO4 | 0,001 н. | |||
| Co(OH)2 | NaOH | 0,04 М | CoCl2 | 0,004 М | |||
| AgI | KI | 0,01 М. | AgNO3 | 0,1 М | |||
| MnS | MnCl2 | 0,05 н. | (NH4)2S | 0,1 н. | |||
| Ag2CrO4 | K2CrO4 | 0,05 н. | AgNO3 | 0,04 М | |||
| PbSO4 | K2SO4 | 0,001 н. | Pb(NO3) | 0,02 н. | |||
| H2SiO3 | HCl | 0,003 М | K2SiO3 | 0,1 н. | |||
| Co(OH)2 | Co(NO3)2 | 0,02 н. | KOH | 0,05 М |
Задача 30
Напишите уравнение реакции получения коллоидного раствора, строение мицеллы которого изображается условной формулой. Укажите заряд коллоидной частицы и ионный стабилизатор.
| Вариант | Формула мицеллы |
| {[Cr(OH)3]m∙nCr3+∙(3n-x)Cl-}∙xCl- | |
| {[AgCl]m∙nAg+∙(n-x)NO3-}∙NO3- | |
| {[BaSO4]m∙nSO42-∙(2n-x)Na+}∙xNa+ | |
| {[Fe4[Fe(CN)6]3]m∙n[Fe(CN)6]4-∙(4n-x)K+}∙xK+ | |
| {[AgBr]m∙nAg+∙(n-x)NO3-}∙NO3- | |
| {[Ni(OH)2]m∙nNi2+∙(2n-x)Cl-}∙xCl- | |
| {[PbI2]m∙nI-∙(n-x)K+}∙xK+ | |
| {[Sb2S3]m∙nHS-∙(n-x)H+}∙xH+ | |
| {[AgCl]m∙nCl-∙(n-x)K+}∙xK+ | |
| {[H2SiO3]m∙nSiO32-∙(2n-x)Na+}∙xNa+ | |
| {[Al(OH)3]m∙nAl3+∙(3n-x)Cl-}∙xCl- | |
| {[As2S3]m∙nHS-∙(n-x)H+}∙xH+ | |
| {[SrSO4]m∙nSr2+∙(2n-x)Cl-}∙xCl- | |
| {[PbCl2]m∙nCl-∙(n-x)K+}∙xK+ | |
| {[Zn(OH)2]m∙nZn2+∙(2n-x)Cl-}∙xCl- | |
| {[Cu2[Fe(CN)6]]m∙nCu2-∙(2n-x)Cl-}∙xCl- | |
| {[BaSO4]m∙nBa2+∙(2n-x)Cl-}∙xCl- | |
| {[Fe(OH)3]m∙nFe3+∙(3n-x)NO3-}∙xNO3- | |
| {[SrSO4]m∙nSO42-∙(2n-x)H+}∙xH+ | |
| {[Fe3[Fe(CN)6]2]m∙n[Fe(CN)6]4-∙(4n-x)K+}∙xK+ | |
| {[AgBr]m∙nBr -∙(n-x)Na+}∙xNa+ | |
| {[Co(OH)2]m∙nCo2+∙(2n-x)Cl-}∙xCl- | |
| {[AgI]m∙nAg+∙(n-x)NO3-}∙NO3- | |
| {[ZnS]m∙nHS-∙(n-x)H+}∙xH+ | |
| {[Ni(OH)2]m∙nNi2+∙(2n-x)Cl-}∙xCl- |
Задача 31
Напишите формулу мицеллы золя, полученного при постепенном приливании к водному раствору первой соли, взятой в избытке, разбавленного раствора второй соли. Укажите знак заряда коллоидной частицы. Какой из электролитов является наиболее экономичным коагулятором этого золя?
| Вар. | Раствор 1 | Раствор 2 | Коагулятор |
| AgNО3 | Kl | NH4CI; K2SО4; FeCI3 | |
| AgNО3 | HCI | NaF; Ca(NО3)2; K2SО4 | |
| AgNО3 | CaCI2 | KCH3COO; ZnCl2; AICl3 | |
| AsCI3 | Na2S | Na2SО4; CaCI2; KNО3 | |
| NiCI2 | H2S | Ba(NО3)2; NaCH3COO; K2SО4 | |
| FeCI3 | NaOH | Na2SО4; KNО3; CaCI2 | |
| FeCI3 | Na2S | SrCI2: NaNО3; K3PО4 | |
| FeCI3 | Na2CО3 | (NH4)2SО4; NaCI; Ca(NО3)2 | |
| FeCI3 | K4[Fe(CN)s] | BaBr2; K2SО4; NaCI | |
| BaCI2 | Na2SО4 | Na2SО4; KNО3; MgCI2 | |
| ZnSО4 | (NH4)2S | NH4CI: AICI3; Na3PО4 | |
| H3AsО3 | H2S | Na2SО4; Al(NО3)3; NH4CI | |
| Kl | AgNО3 | NH4N03: MgBr2; Na2SО4 | |
| HCI | AgNО3 | AI(NО3)3: NH4NО3; K2SО4 | |
| CaCI2 | AgNО3 | Zn(NО3)2; KCH3COО; K3PО4 | |
| Na2S | AsCI3 | Ca(CH3COO)2; KNО3; K3[Fe(CN)6] | |
| H2S | NiCI2 | FeCI3; KBr; Na2SО4 | |
| NaOH | FeCI3 | K3[Fe(CN)6]; ZnCI2; NH4CI | |
| Na2S | FeCI, | NaNО3; (NH4)2SО4; MgCI2 | |
| Na2CО3 | FeCI3 | Na2C2О4: KCI; Cu(NО3)2 | |
| K4[Fe(CN)3] | FeCI3 | NH4CI; Na2S04; CaCI2 | |
| Na2SО4 | BaCI2 | AI(NО3):: KBr; K3PО4 | |
| (NH4)2S | ZnSО4 | NaCI: K2S04; CuCI2 | |
| H2S | H3AsО3 | K2C2О4; AICI3; NH4CH3COO | |
| Kl | Pb(NО3)2 | Ba(NО3)2; NH4NО3; K3[Fe(CN)6] | |
| BaCI2 | Na2SО4 | Na2SО4; KNО3; MgCI2 |
Задача 32
32.1 Вычислить порог коагуляции раствора сульфата натрия, если добавление 0,003 л 0,1 н.  вызывает коагуляцию 0,015 л золя?
вызывает коагуляцию 0,015 л золя?
32.2 Как изменится величина порога коагуляции, если для коагуляции 10 л золя 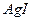 вместо 1,5 л 1 н.
вместо 1,5 л 1 н.  взять 0,5 л 0,1 н.
взять 0,5 л 0,1 н. 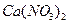 ?
?
32.3 Коагуляция 100 мл золя протекает при добавлении 10,5 мл 1 н. раствора 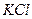 , либо 37,0 мл 0,001 н. раствора
, либо 37,0 мл 0,001 н. раствора  . Вычислить порог коагуляции электролитов и определить знак заряда частиц золя.
. Вычислить порог коагуляции электролитов и определить знак заряда частиц золя.
32.4 Для коагуляции 0,05 л золя сульфида мышьяка можно добавить один из следующих растворов электролитов: 0,005 л 2 н. 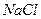 ; 0,005 л 0,03 н.
; 0,005 л 0,03 н.  ; 0,004 л 0,0005 н.
; 0,004 л 0,0005 н. 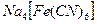 . У какого из приведенных электролитов наименьший порог коагуляции?
. У какого из приведенных электролитов наименьший порог коагуляции?
32.5 Золь сульфида кадмия получен смешиванием равных объемов растворов  и
и  . Пороги коагуляции для различных электролитов имеют следующие значения (ммоль/л):
. Пороги коагуляции для различных электролитов имеют следующие значения (ммоль/л):  ;
;  ;
;  ;
;  ;
;  ;
;  . Какой из электролитов -
. Какой из электролитов -  или
или  - взят в избытке для приготовления золя? Вычислить коагулирующие способности электролитов.
- взят в избытке для приготовления золя? Вычислить коагулирующие способности электролитов.
32.6 В три колбы налито по 0,1 л золя  . Для того, чтобы вызвать коагуляцию золя, потребовалось добавить в первую колбу 0,01 л 1н.
. Для того, чтобы вызвать коагуляцию золя, потребовалось добавить в первую колбу 0,01 л 1н.  , во вторую - 0,063 л 0,01н.
, во вторую - 0,063 л 0,01н.  , в третью -0,037 л 0,001 н.
, в третью -0,037 л 0,001 н.  . Вычислить порог коагуляции каждого электролита и определить знак заряда частиц золя.
. Вычислить порог коагуляции каждого электролита и определить знак заряда частиц золя.
32.7 Пороги коагуляции для различных электролитов и золя иодида серебра имеют следующие значения (ммоль/л):  ;
;  ;
;  ;
; 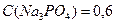 ;
;  ;
;  . Какой из электролитов (иодид калия или нитрат серебра) взят в избытке для приготовления золя?
. Какой из электролитов (иодид калия или нитрат серебра) взят в избытке для приготовления золя?
32.8 Какой объем 0,0002 М  требуется для коагуляции 0,025 л золя сульфида мышьяка, если порог коагуляции
требуется для коагуляции 0,025 л золя сульфида мышьяка, если порог коагуляции  ?
?
32.9 Коагуляция золя иодида серебра, частицы которого заряжены отрицательно, вызывается катионами добавляемых электролитов. Порог коагуляции 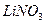 для этого золя равен
для этого золя равен
165 ммоль/л. Вычислить порог коагуляции 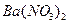 и
и  для этого золя.
для этого золя.
32.10 Как изменится порог коагуляции электролита для золя бромида серебра, частицы которого заряжены положительно, если для коагуляции 0,1 л золя вместо 0,0015 л 0,1 н.  .взят раствор
.взят раствор  ?
?
32.11 Чтобы вызвать коагуляцию золя  к 10 мл золя добавлено в первом случае 1,05 мл 1н.
к 10 мл золя добавлено в первом случае 1,05 мл 1н. 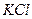 , во втором - 6,25 мл 0,01 н.
, во втором - 6,25 мл 0,01 н.  и в третьем случае 3,7 мл 0,001н.
и в третьем случае 3,7 мл 0,001н.  . Определить знак заряда частиц золя и вычислить порог коагуляции каждого электролита.
. Определить знак заряда частиц золя и вычислить порог коагуляции каждого электролита.
32.12 Какое количество электролита 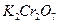 нужно добавить к 1 л золя
нужно добавить к 1 л золя  , чтобы вызвать его коагуляцию? Концентрация электролита 0,01 моль/л, порог коагуляции равен 0,63 ммоль/л.
, чтобы вызвать его коагуляцию? Концентрация электролита 0,01 моль/л, порог коагуляции равен 0,63 ммоль/л.
32.13 Пороги коагуляции электролитов для золя 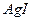 :
:
электролит 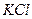

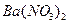


Ск, ммоль/л 256 260 6,0 7,0 0,067.
Каков знак заряда коллоидных частиц? Вычислить коагулирующую способность каждого электролита.
32.14 Как изменится порог коагуляции золя  , если для коагуляции 0,5 л золя вместо 0,005 л 0,01н.
, если для коагуляции 0,5 л золя вместо 0,005 л 0,01н.  взять 0,005 л 0,001 н.
взять 0,005 л 0,001 н. 

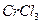 ?
?
32.15 В колбы налито по 25 мл золя  . Для того, чтобы вызвать коагуляцию золя, потребовалось добавить: в первую -
. Для того, чтобы вызвать коагуляцию золя, потребовалось добавить: в первую -
2,65 мл 1н. раствора 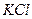 , во вторую - 9,35 мл 0,001 н. раствора
, во вторую - 9,35 мл 0,001 н. раствора  . Вычислить пороги коагуляции и определить знак заряда золя.
. Вычислить пороги коагуляции и определить знак заряда золя.
32.16 Какое количество раствора  концентрацией
концентрацией
0,01 моль/л требуется для коагуляции 1 л золя  ? Порог коагуляции - 9,6 10-2 ммоль/л.
? Порог коагуляции - 9,6 10-2 ммоль/л.
32.17 Пороги коагуляции электролитов для некоторого золя оказались равными (ммоль/л):  ;
;  ;
;  . Определить коагулирующие способности этих электролитов и знак заряда частиц золя.
. Определить коагулирующие способности этих электролитов и знак заряда частиц золя.
32.18 Коагуляция золя  вызывается анионами добавляемых электролитов. Порог коагуляции
вызывается анионами добавляемых электролитов. Порог коагуляции 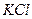 для этого золя равен 260 ммоль/л. Вычислить пороги коагуляции
для этого золя равен 260 ммоль/л. Вычислить пороги коагуляции  и
и 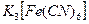 для этого золя.
для этого золя.
32.19 Для явной коагуляции 50 мл золя  потребовалось 5,3 мл 1н.
потребовалось 5,3 мл 1н. 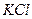 , 31,5 мл 0,01н.
, 31,5 мл 0,01н.  или 18,7 мл 0,001 н.
или 18,7 мл 0,001 н.  . Вычислить пороги коагуляции электролитов. Проверить справедливость правила Шульце-Гарди.
. Вычислить пороги коагуляции электролитов. Проверить справедливость правила Шульце-Гарди.
32.20 Коагуляция золя  вызывается катионами. Пороги коагуляции для электролитов
вызывается катионами. Пороги коагуляции для электролитов  и
и  соответственно равны 50,0 и 0,093 ммоль/л. Как относятся между собой коагулирующие способности катионов добавляемых электролитов?
соответственно равны 50,0 и 0,093 ммоль/л. Как относятся между собой коагулирующие способности катионов добавляемых электролитов?
32.21 Какой объем 0,005 М  требуется для коагуляции 0,015 л золя бромида серебра, если порог коагуляции
требуется для коагуляции 0,015 л золя бромида серебра, если порог коагуляции  ?
?
32.22 Пороги коагуляции электролитов для золя  ммоль/:
ммоль/:  -315;
-315;  -0,6;
-0,6; 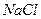 -300;
-300;  -330;
-330;  -20. Каков знак заряда коллоидных частиц? Согласуются ли опытные данные с правилом Шульце-Гарди?
-20. Каков знак заряда коллоидных частиц? Согласуются ли опытные данные с правилом Шульце-Гарди?
32.23 Пороги коагуляции золя  для электролитов
для электролитов 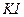 и
и 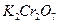 соответственно равны 9,0 и 0,17 ммоль/л. Во сколько раз коагулирующая способность
соответственно равны 9,0 и 0,17 ммоль/л. Во сколько раз коагулирующая способность 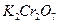 больше, чем у
больше, чем у 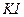 ?
?
32.24 Вычислить порог коагуляции раствора хлорида магния, если добавление 0,006 л 0,01 н.  вызывает коагуляцию
вызывает коагуляцию
0,003 л золя?
32.25 В две колбы налито по 200 мл золя. Для начала коагуляции необходимо добавить 125 мл 0,01 н.  или 74 мл 0,001 н.
или 74 мл 0,001 н.  . Вычислить пороги коагуляции и определить знак заряда золя.
. Вычислить пороги коагуляции и определить знак заряда золя.
ПРИЛОЖЕНИЕ
Приложение 1. Криоскопические ( 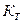 ) и эбулиоскопические (
) и эбулиоскопические (  )
)
константы некоторых растворителей
| Растворитель | 
| 
|
| Анилин | 5,87 | 3,22 |
| Бензол | 5,12 | 2,53 |
| Вода | 1,86 | 0,52 |
| Диэтиловый эфир | 1,73 | |
| Камфора | 40,0 | 6,09 |
| Хлороформ | 4,9 | 3,63 |
| Четыреххлористый углерод | 2,98 | 5,3 |
| Этиловый спирт | - | 3,89 |
Приложение 2. Приближенные значения коэффициентов активности ионов в зависимости от ионной силы раствора
| Ионная сила раствора | Коэффициенты активности ионов | |||
| 1-зарядных | 2-зарядных | 3-зарядных | 4-зарядных | |

| 0,96 | 0,86 | 0,73 | 0,56 |

| 0,95 | 0,81 | 0,64 | 0,45 |
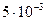
| 0,92 | 0,72 | 0,52 | 0,30 |

| 0,89 | 0,63 | 0,39 | 0,19 |

| 0,87 | 0,57 | 0,28 | 0,12 |

| 0,81 | 0,44 | 0,15 | 0,04 |
| 0,1 | 0,78 | 0,33 | 0,08 | 0,01 |
| 0,2 | 0,70 | 0,24 | 0,04 | 0,003 |
| 0,3 | 0,66 |
Приложение 3. Константы диссоциации некоторых кислот и оснований при Т=298 К
| Название | Формула | 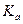
|
| Азотистая | 
| 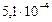
|
| Молибденовая | 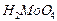
| 
|
| Ортомышьяковая | 
| 
|
| Фтороводородная | 
| 
|
| Родановодородная | 
| 
|
| Сернистая | 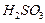
| 
|
| Сероводородная | 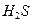
| 
|
| Угольная | 
| 
|
| Ортофосфорная | 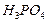
| 
|
| Хлорноватистая | 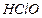
| 
|
| Бензойная | 
| 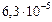
|
| Муравьиная | 
| 
|
| Уксусная | 
| 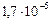
|
| Щавелевая | 
| 
|
| Гидроксид аммония | 
| 
|
| Гидроксид алюминия | 
| 
|
| Гидроксид бериллия | 
| 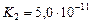
|
| Гидроксид кадмия | 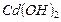
| 
|
| Название | Формула | 
|
| Гидроксид меди(II) | 
| 
|
| Гидроксид никеля(II) | 
| 
|
| Гидроксид свинца(II) | 
| 
|
| Гидроксид хрома(III) | 
| 
|
| Гидроксид цинка | 
| 
|
| Циановодородная | 
| 
|
| Селеноводородная | 
| 
|
Приложение 4. Растворимость ионных соединений в воде
| Соли | Анион | Хорошо растворимые | Малорастворимые |
| Нитраты | 
| Все | Нет |
| Ацетаты | 
| Все | Нет |
| Перхлораты | 
| Все | Нет |
| Хлораты | 
| Все | Нет |
| Сульфаты | 
| Все, кроме | 
|
| Хлориды | 
| Все, кроме | 
|
| Бромиды | 
| Все, кроме | 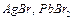
|
| Иодиды | 
| Все, кроме | 
|
| Сульфиды | 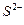
| 
| Все остальные |
| Сульфиты | 
| 
| Все остальные |
| Карбонаты | 
| 
| Все остальные |
| Соли | Анион | Хорошо растворимые | Малорастворимые |
| Фосфаты | 
| 
| Все остальные |
| Силикаты |  - -
| 
| Все остальные |
| Хроматы | 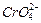
| 
| Все остальные |
| Фториды | 
| 
| Все остальные |