 |
|
КОНТРОЛЬНЫЕ Задания для самостоятельноЙ рАБОТЫ
Задача 22 
22.1 При комнатной температуре растворимость фосфата кальция  равна 1,7∙10-3 г/л. Чему равно произведение растворимости этой соли при той же температуре?
равна 1,7∙10-3 г/л. Чему равно произведение растворимости этой соли при той же температуре?
22.2 Растворимость иодида свинца (II) при  равна 6,5∙10-4 моль/л. Рассчитайте произведение растворимости иодида
равна 6,5∙10-4 моль/л. Рассчитайте произведение растворимости иодида
свинца (II).
22.3 Вычислите произведение растворимости хромата серебра 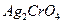 , если в 500 мл воды растворяется 0,011 г
, если в 500 мл воды растворяется 0,011 г 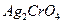 при
при  .
.
22.4 Рассчитайте произведение растворимости карбоната серебра  в насыщенном растворе при
в насыщенном растворе при  , если массовая доля этой соли равна 0,0086 % (плотность раствора принять равной 1г/мл).
, если массовая доля этой соли равна 0,0086 % (плотность раствора принять равной 1г/мл).
22.5 Найдите значение произведения растворимости карбоната магния 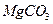 , если растворимость
, если растворимость 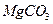 при
при  равна 6,67∙10-2 г/л.
равна 6,67∙10-2 г/л.
22.6 В 1 л насыщенного раствора фосфата свинца  при
при  содержится 1,2∙10-6 г растворенной соли. Вычислите произведение растворимости соли.
содержится 1,2∙10-6 г растворенной соли. Вычислите произведение растворимости соли.
22.7 В 100 мл насыщенного раствора иодида свинца содержится при 20°С 0,0268 г свинца в виде ионов. Вычислите произведение растворимости иодида свинца (II).
22.8 Растворимость сульфида мышьяка (III) при  равна 8,1∙10-7 моль/л. Вычислите произведение растворимости
равна 8,1∙10-7 моль/л. Вычислите произведение растворимости  .
.
22.9 В 500 мл насыщенного раствора фторида свинца при  содержится 0,245 г растворенного вещества. Вычислите произведение растворимости
содержится 0,245 г растворенного вещества. Вычислите произведение растворимости 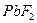 .
.
22.10 Концентрация ионов  в насыщенном растворе
в насыщенном растворе  при
при  равна 6∙10-10 моль/л. Вычислите произведение растворимости
равна 6∙10-10 моль/л. Вычислите произведение растворимости  .
.
22.11 Насыщенный раствор  объемом 3 л при
объемом 3 л при  содержит в виде ионов 0,176 г серебра. Вычислите произведение растворимости иодата серебра.
содержит в виде ионов 0,176 г серебра. Вычислите произведение растворимости иодата серебра.
22.12 В 100 мл воды при  растворяется 8,78·10-3 г пирофосфата бария. Вычислите произведение растворимости
растворяется 8,78·10-3 г пирофосфата бария. Вычислите произведение растворимости  .
.
22.13 Найдите произведение растворимости, зная, что концентрация гидроксида кобальта (II)  при
при  равна
равна
0,4∙10-5 моль/л.
22.14 Чему равно произведение растворимости бромида свинца , если растворимость при 
 равна 0,427 г?
равна 0,427 г?
22.15 Рассчитайте произведение растворимости вольфрамата серебра, если массовая доля 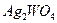 в насыщенном растворе при
в насыщенном растворе при  равна 0,00012 (плотность раствора принять равной
равна 0,00012 (плотность раствора принять равной
1 г/мл).
22.16 Определите произведение растворимости фторида
магния, если растворимость в воде при 
 равна
равна
0,001 моль/л.
22.17 Растворимость гидроксида железа (III) при  равна
равна
1,9∙10-10 моль/л. Вычислите произведение растворимости  .
.
22.18 Растворимость фосфата серебра в воде при  равна 0,0065 г/л. Рассчитайте произведение растворимости
равна 0,0065 г/л. Рассчитайте произведение растворимости  .
.
22.19 В 200 мл воды при  растворяется 0,35 г
растворяется 0,35 г  . Определите произведение растворимости этой соли.
. Определите произведение растворимости этой соли.
22.20 Рассчитайте произведение растворимости гидроксида железа (II), если растворимость  при
при  равна
равна
0,5∙10-5 моль/л.
22.21 Концентрация ионов  в насыщенном растворе при
в насыщенном растворе при  равна 5,9∙10-3 моль/л. Вычислите произведение растворимости сульфата стронция.
равна 5,9∙10-3 моль/л. Вычислите произведение растворимости сульфата стронция.
22.22 В 6 л насыщенного раствора сульфата свинца содержится при  в виде ионов 0,186 г свинца. Вычислите произведение растворимости
в виде ионов 0,186 г свинца. Вычислите произведение растворимости 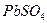 .
.
22.23 Растворимость хлорида свинца при  равна 10,58 г/л. Вычислите произведение растворимости
равна 10,58 г/л. Вычислите произведение растворимости  .
.
22.24 Растворимость бромида серебра при  равна
равна
1∙10-5 г/100 г  . Определите произведение растворимости
. Определите произведение растворимости  .
.
22.25 Чему равно произведение растворимости гидроксида цинка  , если при
, если при  его растворимость равна
его растворимость равна
2,2∙10-5 г/100 г  .
.
Задача 23
23.1 Произведение растворимости сульфата бария равно
1,1∙10-10 при  . Вычислите растворимость
. Вычислите растворимость  в моль/л и г/л.
в моль/л и г/л.
23.2 Произведение растворимости сульфата кальция составляет 9,1∙10-6 при  . Рассчитайте растворимость
. Рассчитайте растворимость  в моль/л. Сколько граммов кальция в виде ионов содержится в
в моль/л. Сколько граммов кальция в виде ионов содержится в
300 мл насыщенного раствора?
23.3 При  произведение растворимости фосфата свинца
произведение растворимости фосфата свинца  равно 1,5∙10-32. Какова растворимость этой соли в г/л и молярная концентрация ионов соли в насыщенном растворе?
равно 1,5∙10-32. Какова растворимость этой соли в г/л и молярная концентрация ионов соли в насыщенном растворе?
23.4 При  произведение растворимости сульфида меди (I) равно 2∙10-47. Рассчитайте растворимость
произведение растворимости сульфида меди (I) равно 2∙10-47. Рассчитайте растворимость  в моль/л, г/л и концентрацию ионов
в моль/л, г/л и концентрацию ионов  .
.
23.5 При комнатной температуре произведение растворимости гидроксида никеля (II) равно 1,6∙10-14. Какова растворимость  в моль/л?
в моль/л?
23.6 Вычислите концентрации ионов в моль/л и г/л и молярную растворимость гидроксида магния в насыщенном растворе, если произведение растворимости 
 при
при  равно
равно
3,2∙10-11.
23.7 Произведение растворимости карбоната кальция при  равно 4,8∙10-9. Рассчитайте растворимость
равно 4,8∙10-9. Рассчитайте растворимость  в моль/л и концентрации ионов в моль/л и г/л.
в моль/л и концентрации ионов в моль/л и г/л.
23.8 Вычислите растворимость карбоната серебра  в насыщенном растворе, если его произведение растворимости при
в насыщенном растворе, если его произведение растворимости при  равно 5,0∙10-12. Сколько граммов серебра в виде ионов содержится в 500 мл насыщенного раствора?
равно 5,0∙10-12. Сколько граммов серебра в виде ионов содержится в 500 мл насыщенного раствора?
23.9 Произведение растворимости хлорида серебра при  равно 1,4∙10-4. Найдите растворимость
равно 1,4∙10-4. Найдите растворимость  в кипящей воде в моль/л.
в кипящей воде в моль/л.
23.10 В насыщенном растворе фосфата магния объемом 10 л содержится 3 г  . Вычислите растворимость и концентрации ионов соли в моль/л.
. Вычислите растворимость и концентрации ионов соли в моль/л.
23.11 Чему равна концентрация ионов  и
и  в насыщенном растворе сульфата свинца и его растворимость, выраженная в моль/л и г/л? Произведение растворимости
в насыщенном растворе сульфата свинца и его растворимость, выраженная в моль/л и г/л? Произведение растворимости 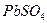 при
при  равно 2,2∙10-8.
равно 2,2∙10-8.
23.12 Концентрация йодид-ионов в насыщенном растворе иодида свинца (II) равна 1,3∙10-3 моль/л. Определите растворимость в моль/л и г/л и концентрацию  в этом растворе.
в этом растворе.
23.13 Произведение растворимости  составляет 1∙10-22. В каком объеме насыщенного раствора содержится 6,4 мг этой соли?
составляет 1∙10-22. В каком объеме насыщенного раствора содержится 6,4 мг этой соли?
23.14 Вычислите растворимость фосфата серебра в моль/л и г/л. Произведение растворимости  при
при  равно 1,8∙10-18.
равно 1,8∙10-18.
23.15 Вычислите растворимость 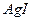 в моль/л и г/л и концентрации ионов. Произведение растворимости иодида серебра равно 8,3∙10-17.
в моль/л и г/л и концентрации ионов. Произведение растворимости иодида серебра равно 8,3∙10-17.
23.16 Произведение растворимости фторида свинца 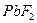 при
при  равно 3,2∙10-8. Сколько граммов свинца в виде ионов содержится в 400 мл насыщенного раствора?
равно 3,2∙10-8. Сколько граммов свинца в виде ионов содержится в 400 мл насыщенного раствора?
23.17 Рассчитайте концентрации ионов 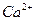 и
и 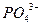 в насыщенном растворе
в насыщенном растворе  при
при  , если произведение растворимости при этой температуре равно 1∙10-25.
, если произведение растворимости при этой температуре равно 1∙10-25.
23.18 При  произведение растворимости иодида свинца (II) равно 8,7∙10-9. Вычислите концентрации ионов
произведение растворимости иодида свинца (II) равно 8,7∙10-9. Вычислите концентрации ионов  и
и  в насыщенном растворе иодида свинца (II).
в насыщенном растворе иодида свинца (II).
23.19 Вычислите концентрации ионов в моль/л и г/л и растворимость  в моль/л в насыщенном растворе. Произведение растворимости
в моль/л в насыщенном растворе. Произведение растворимости  при
при  равно 3,2∙10-11.
равно 3,2∙10-11.
23.20 Рассчитайте равновесную молярную концентрацию ионов  в насыщенном растворе
в насыщенном растворе 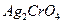 при
при  . Произведение растворимости хромата серебра равно 1,2∙10-12.
. Произведение растворимости хромата серебра равно 1,2∙10-12.
23.21 Произведение растворимости  равно 1,6∙10-10. Вычислить концентрацию насыщенного раствора
равно 1,6∙10-10. Вычислить концентрацию насыщенного раствора  в моль/л и г/л.
в моль/л и г/л.
23.22 Вычислите концентрации ионов в моль/л и г/л и молярную растворимость  в насыщенном растворе. Произведение растворимости
в насыщенном растворе. Произведение растворимости  при
при  равно 1,9 10-9.
равно 1,9 10-9.
23.23 Вычислите концентрацию ионов 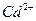 в насыщенном водном растворе карбоната кадмия
в насыщенном водном растворе карбоната кадмия 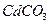 , если произведение растворимости
, если произведение растворимости 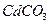 при
при  равно 2,5∙10-14.
равно 2,5∙10-14.
23.24 Рассчитайте концентрации ионов 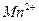 и
и  в насыщенном растворе
в насыщенном растворе  при
при  , если произведение растворимости при этой температуре равно 1,1∙10-15.
, если произведение растворимости при этой температуре равно 1,1∙10-15.
23.25 Произведение растворимости  равно 1,6∙10-10. Вычислить концентрацию насыщенного раствора
равно 1,6∙10-10. Вычислить концентрацию насыщенного раствора  в моль/л и г/л.
в моль/л и г/л.
Задача 24
Образуется ли осадок при сливании растворов  и
и 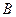 с указанными объемами и концентрациями.
с указанными объемами и концентрациями.
| Вар. | Раствор 
| Раствор 
| Осадок | 
|
| 10 мл 0,01 н. CuSО4 | 15 мл 0,02 н. Na2S | CuS | 4∙10-38 | |
| 6 мл 0,04 н. LaCI3 | 9 мл 0,04 н. КОН | La(OH)3 | 5∙10-21 | |
| 10 мл 0,01 M CaCI2 | 5 мл 0,1 н. К2CrO4 | CaCrО4 | 2,3∙10-2 | |
| 10 мл 0,005 М BaCI2 | 6 мл 0,1 н. Na2S04 | BaSО4 | 1,1∙10-10 | |
| 50 мл 0,01н. Pb(NО3)2 | 30 мл 0,001 М H2SО4 | PbSО4 | 2,2∙10-8 | |
| 15 мл 0,01н. Ca(NО3)2 | 5 мл 0,2 н. (NH4)2CО3 | CaCО3 | 4,4∙10-9 | |
| 10 мл 0,1 н. MgSО4 | 2 мл 0,02 н. NaOH | Mg(OH)2 | 1,9∙10-12 | |
| 15 мл 0,05 н. Pb(NО3)2 | 5 мл 0,04 М HCI | PbCI2 | 1,7∙10-5 | |
| 6 мл 0,002 н. CuSО4 | 6 мл 0,001 М NaOH | Cu(ОH)2 | 5,6∙10-20 | |
| 20 мл 0,05 н. CaCl2 | 10 мл 0,005M Na2CО3 | CaCО3 | 4,8∙10-9 | |
| 2 мл 0,08 М AgNО3 | 6 мл 0,02 М К2CО3 | Ag2CО3 | 5∙10-12 | |
| 5 мл 0,006 М FeCI2 | 2 мл 0,004 М NaOH | Fe(ОH)2 | 7,9∙10-16 | |
| 3 мл 0,01 н. SrCI2 | 3 мл 0,01 М K2SО4 | SrSО4 | 2,1 ∙10-7 | |
| 15 мл 0,004н.Mg(NО3)2 | 10 мл 0,0006 н. Na2S | MgS | 2∙10-15 | |
| 50 мл 0,1н. Cd(NО3)2 | 40 мл 0,01 М Na2S | CdS | 7,1∙10-23 | |
| 10 мл 0,05 М AgNО3 | 5 мл 0,0005 н. К2Сг2О7 | Ag2Cr2О7 | 2∙10-7 | |
| 5 мл 0,003 М Pb(NО3)2 | 5 мл 0,003 н. К2С2O4 | PbC2О4 | 7,3∙10-4 | |
| 15 мл 0,004н. CdCI2 | 6 мл 0,002 М NaOH | Cd(OH)2 | 4,3∙10-15 | |
| 2 мл 0,05н. ZnSО4 | 4 мл 0,005 М Na2S | ZnS | 7,9∙10-24 | |
| 6 мл 0,002 М MnSО4 | 2 мл 0,001 М NaOH | Mn(OH)2 | 2,3∙10-13 | |
| 1 мл 0,003 н. CaCI2 | 1 мл 0,005 н. Na3PО4 | Ca3(PО4)2 | 1∙10-25 | |
| 2 мл 0,001н. AgNО3 | 5 мл 0,01 н. К3РО4 | Ag3PО4 | 1,8∙10-18 | |
| 5 мл 0,0002 н. CoCI2 | 5 мл 0,0001 М NaOH | Co(OH)2 | 1,6∙10-15 | |
| 10 мл 0,0023 М AgNО3 | 15 мл 0,0023 н. КВr | AgBr | 5∙10-13 | |
| 2 мл 0,005 н. NiCI2 | 8 мл 0,0001 М NaOH | Ni(OH)2 | 1,4∙10-8 |