 |
|
Теоретическое введение
Модели атома Томсона и Резерфорда. Трудности ядерной модели.
В 1903 г. Томсон предложил модель атома, согласно которой атом представляет собой равномерно заполненную положительным зарядом сферу, внутри которой находится электрон. Суммарный положительный заряд сферы равен суммарному заряду электронов, так что атом в целом нейтрален. Электрон, выведенный из положения равновесия, совершает колебания под действием кулоновских сил. Однако в дальнейшем выяснилась несостоятельность этой модели.
Для того чтобы выяснить характер распределения положительных и отрицательных зарядов в атоме, было необходимо непосредственное опытное «зондирование» внутренних областей атома. Такое зондирование осуществили Резерфорд и его сотрудники с помощью α-частиц, наблюдая их рассеяние при прохождении через тонкую металлическую фольгу.
Оказалось, что некоторое количество α-частиц рассеивается на очень большие углы (почти до 1800). Столь сильное отклонение α-частиц возможно только в том случае, если внутри атома имеется чрезвычайно сильное электрическое поле, которое создается зарядом, связанным с большой массой и сконцентрированным в очень малом объеме. Основываясь на этом выводе, Резерфорд предложил в 1911 г. ядерную модель атома. Согласно предположению Резерфорда, атом представляет собой систему зарядов, в центре которой расположено тяжелое положительное ядро с зарядом Ze, имеющее размеры, не превышающие 10-14 м,а вокруг ядра расположены Z электронов, распределенных по всему объему, занимаемому атомом. Почти вся масса атома сосредоточена в ядре.
Весь положительный заряд атома сосредоточен в его ядре – области, занимающей весьма малый объем по сравнению со всем объемом атома. Рассеяние α-частицы на таком малом объекте маловероятно, поэтому большинство α-частиц испытывает незначительное рассеяние; α-частицы, проходящие вблизи от ядра, испытывают резкие отклонения, так как на малых расстояниях силы отталкивания между положительно заряженными α-частицей и ядром должны быть очень велики. Вероятность попаданий α-частиц в ядро и их отклонений на большие углы сравнительно мала, но не равна нулю.
Поскольку система неподвижных зарядов не может находиться в устойчивом состоянии, Резерфорду пришлось отказаться от статической модели атома и предположить, что электроны движутся вокруг ядра, описывая замкнутые траектории. Модель часто называют планетарной,по аналогии с Солнечной системой: в центре системы находится «солнце» – ядро, а вокруг него по орбитам движутся «планеты» – электроны.
Однако ядерная модель оказалась в противоречии с законами классической механики и электродинамики. Электрон по орбите будет двигаться с ускорением, в связи с чем, согласно классической электродинамике, он должен непрерывно излучать электромагнитные (световые) волны. Процесс излучения сопровождается потерей энергии, так что электрон должен в конечном счете упасть на ядро. Атом Резерфорда оказался неустойчивой системой, что противоречит опыту.
Далее, модель Резерфорда не могла объяснить линейчатый характер спектров атомов. Из модели следовало, что электромагнитное излучение атома имеет непрерывный, а не линейчатый спектр, так как электрон не удерживается на круговой орбите, а по спирали приближается к ядру, и частота его обращения вокруг ядра (а следовательно, и частота излучаемых им электромагнитных волн) непрерывно изменяется.
Линейчатый спектр атома водорода.
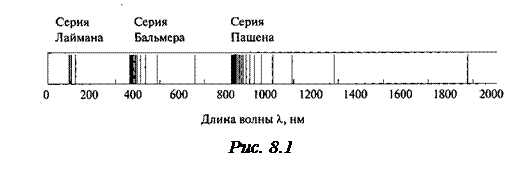 Атомы поглощают и испускают свет только определённой длины волны, причём спектральные линии группируются в серии (на рис.8.1 приведён спектр водорода).
Атомы поглощают и испускают свет только определённой длины волны, причём спектральные линии группируются в серии (на рис.8.1 приведён спектр водорода).
Для спектра водорода, простейшего из атомов, была установлена (не выведена, а угадана!) несложная формула
 . (8.1)
. (8.1)
Здесь λ – длина волны излучения, n и k (k<n) – целые числа, а R – постоянная Ридберга (R=1.1.107 м-1). Оказалось, что серия Лаймана (см. рис.8.1) получается при k=1, n=2, 3, 4, …∞; серия Бальмера (она наблюдается в видимой области спектра) – при k=2, n=3, 4, 5, …∞; серия Пашена – при k=3, n=4, 5, 6, …∞ и так далее.
Теория Бора атома водорода и водородоподобных ионов
Первая попытка построения неклассической теории атома была предпринята Бором (1913) и составила важный этап в развитии современной физики. В основе этой теории лежала идея связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атомов Резерфорда и квантовый характер излучения и поглощения света, подтвержденные обширным экспериментальным материалом. В теории Бора не содержалось принципиального отказа от описания поведения электрона в атоме при помощи законов классической физики. Однако классическое описание дополнялось некоторыми ограничениями, накладываемыми на возможные состояния электронов в атоме. Эти ограничения были сформулированы в виде постулатов, физический смысл которых не мог быть объяснен в рамках теории, но, более того, противоречил сохраняющемуся в теории классическому описанию движения электрона в атоме. Тем не менее, такой принципиально непоследовательный путь привел к правильным результатам в некоторых вопросах. Теория Бора базировалась на следующих постулатах:
Постулат стационарных состояний:
1. Электрон в атоме может находится только на стационарной орбите; при этом он не излучает и не поглощает энергии. Круговые стационарные орбиты определяются условием квантования момента импульса  :
:
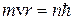 . (n=1, 2, 3,…∞) (8.2)
. (n=1, 2, 3,…∞) (8.2)
Здесь n – номер орбиты,  =1.05.10-34Дж.с – постоянная Планка, m – масса электрона, v и r – скорость электрона на орбите соответствующего радиуса.
=1.05.10-34Дж.с – постоянная Планка, m – масса электрона, v и r – скорость электрона на орбите соответствующего радиуса.
Правило частот:
2. Излучение энергии атомом происходит только при переходе электрона с одной орбиты (n) на другую (k<n). При переходе с одной стационарной орбиты на другую электрон излучает (поглощает) квант света с частотой ν и энергией hν, равной разности энергий стационарных состояний, между которыми произошел переход:
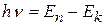 . (8.3)
. (8.3)
Этот постулат отражает закон сохранения энергии и гипотезу Планка-Эйнштейна о квантах.
Рассмотрим электрон, движущийся в поле атомного ядра с зарядом Ze. При Z=1 такая система соответствует атому водорода, при иных Z – водородоподобному иону, т.е. атому с порядковым номером Z, из которого удалены все электроны, кроме одного (рис.8.2). По второму закону Ньютона произведение массы электрона на его центростремительное ускорение должно равняться кулоновской силе притяжения электрона к ядру:
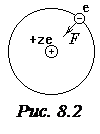
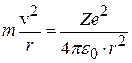 . (8.4)
. (8.4)
Из (8.2) и (8.4) получим:
 ; (8.5)
; (8.5)
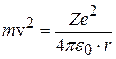 . (8.6)
. (8.6)
После подстановки (8.5) в (8.6) и сокращения:
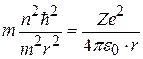 ;
; 
можно найти радиус орбиты с номером n:
 . (8.7)
. (8.7)
Таким образом, радиус электронных орбит в атоме может принимать лишь ряд дискретных значений. Для первой орбиты атома водорода а0≡ r1=53 пм – первый Боровский радиус.
Энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и потенциальной энергии взаимодействия электрона с ядром:
 . (8.8)
. (8.8)
Из (8.6) следует, что кинетическая энергия  , тогда
, тогда
 . (8.9)
. (8.9)
Подставив в (8.9) радиус орбиты (8.7), получим дозволенные значения энергии атома En:
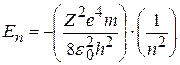 , (8.10)
, (8.10)
где n=1, 2, 3,…∞.
Схема энергетических уровней, определяемых (8.10), дана на рис.8.3.
Состояние с минимальной энергией (n=1) называется основным. Тогда энергия электрона в атоме водорода равна Е1=–13.6 эВ. Электрон не связан с ядром, когда n→∞, Е∞=0. Таким образом, энергия ионизации атома водорода из основного состояния равна:
EИ=(Е∞–Е1)=13.6 эВ.
При переходе атома водорода из состояния n в состояние k в соответствии со вторым постулатом Бора (8.3) испускается квант с энергией
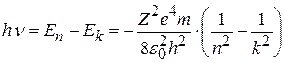 . (8.11)
. (8.11)
Тогда для длины волны излучения:
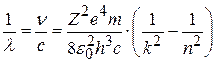 , (8.12)
, (8.12)
где с – скорость света. Сравнив (8.1) и (8.12), получим значение постоянной Ридберга (для водорода Z=1):

 . (8.13)
. (8.13)
После подстановки значений величин получим  . Таким образом, теория Бора позволила также вычислить постоянную Ридберга.
. Таким образом, теория Бора позволила также вычислить постоянную Ридберга.
Трудности теории Бора. Совпадение выводов теории Бора с опытными данными для водорода оказалось идеальным. Однако наряду с успехами в теории Бора обнаружились существенные недостатки. Главнейшим из них была внутренняя логическая противоречивость теории: она не была ни последовательно классической, ни последовательно квантовой теорией. В ряде проблем теория Бора привела к существенным трудностям. Наиболее серьёзной неудачей явилась абсолютная невозможность создать теорию атома гелия, содержащего помимо ядра два электрона.
Теория Бора оказалась лишь переходным этапом на пути создания после‑
довательной теории атомных и ядерных явлений. Такой последовательной теорией явилась квантовая механика. Применение её к атомным процессам позволило не только объяснить многообразие явлений атомной и ядерной физики, но и вскрыть физическое содержание самих постулатов Бора.