 |
|
Глава 6. ЦИКЛОАЛКАНЫ
Насыщенные углеводороды, в которых атомы углерода замкнуты в цикл. Общая формула углеводорода с одним циклом CnH2n . Электронные орбитами атомов углерода в циклоалканах находятся в состоянии sp3 -гибридизации.
Все циклоалканы- бесцветные, малорастворимые в воде, горючие вещества. При обычных условиях C3H6, C4H8- газы, С5Н10,С6Н12- жидкости
Структурная изомерия циклоалканов свящзана с различной величиной циклов, видом и строением заместителей и их расположением:

циклогексан метилциклопентан пропилциклопропан

1,2-диметилциклобутан 1,3-диметилциклобутан
6.1.Получение циклоалканов
1. Общий способ получения циклоалканов и их производных – действие металлов (Na, Zn, Mg) на дигалогенпроизводные алканов при нагревании

2. Циклогексан и его производные получают гидрированием бензола:

6.2.Химические свойства циклоалканов
1. Малые циклы (С3-С4), вследствие специфики строения вступают в реакции присоединения с разрывом С-С связи в цикле,циклы с большим числом атомов углерода сходны по химическим свойствам с алканами. Малые циклыприсоединяют галогены, галогеноводороды, водород ( циклобутан не присоединяет галогеноводороды, только водород и галогены)
а)
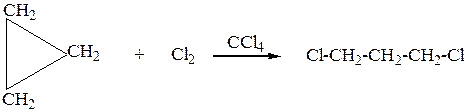
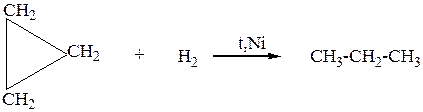
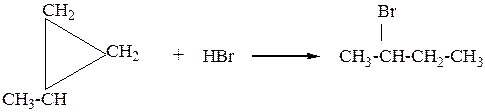
б) Окисление происходит с разрывом цикла.
Например, при окислении циклобутана образуется бутандиовая кислота.
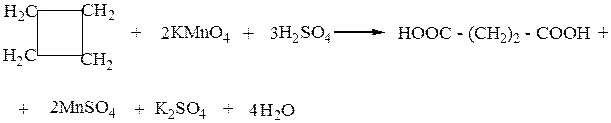
-2 +3
2 C - 10 ē = 2 C процесс окисления
+7 +2
Mn + 5 ē = Mn процесс восстановления
2. Большие циклы ( n>5) с HaI2 реагируют без разрыва цикла, с галогеноводородами в реакции не вступают, нагревание в присутствии никеля приводит к реакциям дегидрирования, при этом образуются ненасыщенные циклические соединения

6.3.Примеры решения задач
Пример 18.
При хлорировании 70 г циклоалкана, в молекуле которого содержится 40 е, было получено монохлорпроизводное массой 83,6 г. Определить выход реакции галогенирования и массовые доли веществ, в полученной жидкой органической смеси.
Решение:
1) Общая формула циклоалканов СnH2n
В одном атоме углерода содержится 6 е, в атоме водорода 1е, в молекуле СnH2n n(е)= 6n+2n=8n
Составляем уравнение: 8n= 40; n=5,
следовательно, циклоалкан С5Н10 - циклопентан
2) Монохлорпроизводное образуется в реакции хлорирования без разрыва цикла
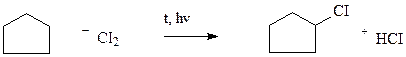
3) Определяем количество вещества циклоалкана:
M (C5H10) = 70г/моль
М (С5Н9Сl) = 104,5 г/моль
n(С5Н10) = m (C5H10)/M(C5H10) = 70/70= 1моль
4) Определяем количество вещества монохлорпроизводного, полученного практически n( С5Н9Сl) = 83,6/104,5 = 0,8 моль
5) Выход в реакции (η ) определяется как отношение количества вещества, полученного практически n(пр) к количеству вещества рассчитанному по уравнению химической реакции (теоретически) n( теор)
η = n(пр) / n(теор) = 0,8: 1 = 0,8 (80%)
6) Таким образом, в жидкой органической смеси после реакции будут находиться хлорциклопентан и непрореагировавший циклопентан:
m ( C5H9Cl) = 83,6 г(по условию) и
n( С5Н10) ост = 1,0-0,8 = 0,2 моль m ( C5H10) ост = 0,2 ∙ 70 =14 г
m (смеси) = 83,6 +14 = 97,6 г
7) Массовая доля циклохлорпентана
ω(С5Н9Сl) = m(C5H9Cl) /m (cм) = 83,6:97,6 = 0,857 (85,7%)
массовая доля оставшегося циклопентана
ω (С5Н10) = m( C5H10) / m (см) = 14 : 97,6 = 0,147 ( 14,7%)
Ответ: ω(С5Н9Сl) = 85,7% ; ω (С5Н10) = 14,7%
Пример 19.
Газовая смесь состоит из пропана, СО2, циклопропана. Выделить каждый компонент газовой смеси в чистом виде.
Решение:
1) В газовой смеси находится углекислый газ, который, в отличие от углеводородов, вступает в реакции со щелочами. Пропустим смесь через избыток раствора гидроксида кальция
СО2 + Са(ОН)2  СаСО3↓ +Н2О
СаСО3↓ +Н2О
Оставшаяся газовая смесь содержит С3Н6 и С3Н8.
Для того чтобы выделить СО2 в чистом виде, отфильтруем осадок и прокалим:
t
СаСО3  CaO +CO2
CaO +CO2
Соберем в пробирку выделившийся газ, получим CO2 в чистом виде
2) Оставшуюся газовую смесь пропустим через избыток раствора бромной воды
C3H6 + Br2(aq)  CH2−CH2−CH3
CH2−CH2−CH3
| |
Br Br
Непрореагировавший газ соберём в пробирку. Получим С3Н8 в чистом виде
3) .На оставшуюся жидкость действуем избытком Zn, при нагревании
CH2−CH−CH3 + Zn  C3H6 + ZnBr2
C3H6 + ZnBr2
| |
Br Br
Выделившийся газ соберём в пробирку, получим циклопропан в чистом виде.
Пример 20.
Среди перечисленных веществ выберете гомологи и изомеры: метилциклобутан, циклобутан, пентен-1, бутен-2, метилбутан, метилпропан.
Решение:
Поскольку, гомологами называтся вещества, отличающиеся друг от друга на одну или несколько гомологических единиц (-СН2-) и имеющие сходное строение и свойства, выберем среди перечисленных веществ гомологи:
1)

метилциклобутан циклобутан
2) CH3−CH2−CH − CH3 ; CH3 −CH −CH3 ;
| |
CH3 СН3
метилбутан метилпропан
3)
СH3−CH2−CH2−CH=CH2 ; СH3−CH=CH−CH3
пентен-1 бутен-2
Изомеры – это вещества, имеющие одинаковый состав, но различное строение.
Изомерами являются:
1)
 и СH3−CH=CH−CH3
и СH3−CH=CH−CH3
циклобутан бутен-2
2) 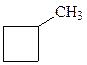 ; и СH3−CH2 −CH2−CH=CH2
; и СH3−CH2 −CH2−CH=CH2
метилциклобутан пентен-1
6.4.Задачи и упражнения для самостоятельного решения
171. С какими перечисленными реагентами будет вступать в реакцию метилциклобутан:
бром, гидроксид натрия, натрий, вода, водород, кислород, бромоводород. Напишите уравнения, укажите условия протекания реакций.
172. Напишите структурные формулы всех дибромпроизводных алканов, из которых при нагревании с натрием может быть получен
1,2-диметил-3-этилциклопропан. Один из них назовите по систематической номенклатуре. Приведите уравнения соответствующих реакций.
173.Напишите структурные формулы и назовите по систематической номенклатуре все дихлорпроизводные алканов, из которых при нагревании с цинком может быть получен
1-изопропил-2,5- диметил-3-этилциклопентан.
Приведите уравнения соответствующих реакций.
174. В продуктах реакции гидрирования циклоалкана был обнаружен
2-метилбутан. Напишите структурные формулы и назовите по систематической номенклатуре все циклоалканы, которые могли бы дать подобный результат.
175. Приведите структурные формулы всех циклоалкенов, в молекуле которых находится 46 электронов. Приведите формулы двух других углеводородов, в молекуле которых будет на 2 е больше.
176.Газовая смесь состоит из пропана, пропина и циклопропана. Выделите каждый компонент газовой смеси в чистом виде.
177.Смесь состоит из 1,6-дибромгексана, циклогексана, циклогексена. Получите максимальное количество чистого циклобромгексана. Приведите уравнения реакций, укажите условия протекания реакций.
178. Идентифицируйте вещества, находящиеся в пробирках без этикеток: а) циклогексан, циклогексен и пентин-1; б) этан, циклопропан, пропин;
в) углекислый газ, ацетилен, метан, циклопропан.
179.Смесь метана, этена и циклопропана имеет плотность по гелию 7,125. К 4 л этой смеси добавили 4 л водорода и пропустили над нагретым платиновым катализатором. При этом объем смеси уменьшился до 5 л. Определите объемные доли газов в исходной смеси.
180.Через бромную воду с массовой долей брома 20 % пропустили 3 л смеси этана и циклопропана с плотностью по водороду 19. Определите, какая масса раствора брома была обесцвечена этой смесью.
181.При гидрировании некоторого циклоалкана массой 11,2 г требуется 4,48 л водорода (н.у.). Напишите структурную формулу исходного циклоалкана.
182.При горении предельного циклического углеводорода образовалось 3,60 г воды. Вычислите массу углекислого газа, которая образуется при этом.
183.15 г смеси гексана, циклогексана и циклогексена обесцветили 76,8 г раствора брома в тетрахлорметане с массовой долей брома 10%. Определите массовую долю циклогексена в смеси.
184.При пропускании 2,24 л ( н.у.) смеси этена, циклобутана и бутана через бромную воду прореагировало 40 г раствора с массовой долей брома 20%. Плотность газовой смеси по водороду равна 24,3. Определите состав смеси углеводородов ( в %% по объёму).
185.Рассчитайте массу раствора бромной воды с массовой долей брома 4%, которая может прореагировать с 10 л ( н.у.) смеси углеводородов, содержащей ( в %% по объёму): 16,4% этана, 33,6% этина и 50% метилциклопропана.
186.Рассчитайте, как изменится масса склянки с бромной водой после пропускания через неё 22,4 л газовой смеси, состоящей из пропана, циклопропана и углекислого газа. Плотность газовой смеси равна
1,607 г/л (н.у.)
187.Для сгорания циклоалкана требуется в 4,5 раза больший объем кислорода, чем объем исходного углеводорода (при одинаковых условиях). Какая масса этого углеводорода сгорела, если масса осадка, образовавшегося при пропускании продуктов реакции через избыток раствора гидроксида бария, составила 1,97 г?
188.При бромировании 92 г метилциклогексана образовалось 108 г монобромпроизводного. Определите выход реакции галогенирования и массовые доли веществ в полученной жидкой органической смеси
Глава 7. АРЕНЫ
Аренами называются циклические непредельные углеводороды с системой сопряженных π -связей. Общая формула аренов СхН2х-6, где х≥6. Простейшим ареном является бензол С6Н6. Структурная формула бензола ранее описывалась шестичленным циклом с 3-мя двойными связями (т.н. формула Кекуле).


Сейчас принято изображать структуру бензола шестиугольником с внутренним кольцом, отражающим существование единой циклической сопряженной системы из 6 р-электронов, хотя допускается и использование формулы Кекуле, помня, однако, что она не вполне соответствует реальному строению бензола.
Если изобразить молекулу бензола как бы «в профиль», то получится что-то вроде сэндвича, где вытянутые овалы соответствуют верхней и нижней областям кольцевой π- электронной системы («вид на бублик сбоку»). Отрезок прямой отвечает проекции плоскости из 6 атомов углерода, связанных σ-связями. Цикл является плоским, так как все атомы углерода в бензоле имеют гибридизацию sp2.
Проекция плоского цикла Отрицательно заряженные облака из 6 σ-
связей С-С сопряженных π-электронов

Так как «овалы» заряжены отрицательно (ведь заряд электронов отрицателен), то отрицательные частицы или отрицательно заряженные фрагменты молекул не могут приблизиться к бензольному кольцу из-за электростатического отталкивания одноименных зарядов. Подойти к молекуле бензола могут т.н. электрофильные частицы - положительные ионы (NO2+) или электроположительные фрагменты молекул. Поэтому
для бензола и аренов в большей степени характерны реакции электрофильного замещения. Кроме этого типа реакций можно назвать реакции радикального замещения, окисления(у гомологов бензола), У бензола – реакции радикального присоединения.
Гомологи. Изомерия.
Ближайшим гомологом бензола является толуол (метилбензол) С6Н5СН3 , у которого изомеров нет.
Для следующего гомолога С8Н10 насчитывается уже 4 изомера. Один из них –этилбензол С6Н5С2Н5,
а три других - изомеры диметилбензола С6Н4(СН 3)2, так называемые ксилолы.

орто-ксилол мета-ксилол пара-ксилол
1,2-диметилбензол 1,3- диметилбензол 1,4-диметилбензол
Изомеров пропилбензола –пять:(н-пропилбензол С6Н5С3Н7, изопропилбензол (кумол) С6Н5СН(СН3)2 и др.) Существуют 3 изомера триметилбензола С6Н3(СН3)3, формулы которых предлагается изобразить самостоятельно.
Важным производным бензола является стирол, который, вообще говоря, не относится к аренам, так как имеет в боковой цепи двойную связь.

винилбензол(стирол)
Физические свойства аренов
Арены плохо растворимы в воде, хорошо -- в органических растворителях, Сами являются хорошими растворителями органических и некоторых неорганических веществ. Плотность их меньше, чем у воды, следовательно, в смесях с водой слой арена будет сверху, а водный – снизу. Температуры кипения относительно невысокие: у бензола 80оС, а у толуола 110оС. Арены имеют характерный, достаточно неприятный запах. Легко воспламеняются, горят ярким, но сильно коптящим пламенем.
7.1.Получение аренов
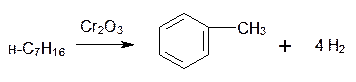
1. Дегидроциклизация(ароматизация) природныхнеразветвленных алканов с цепью, содержащей от 6 и выше атомов углерода -основной промышленный способ.При нагревании над катализатором (Cr2O3 или Pt) происходит замыкание цикла и одновременное отщепление водорода.
Если исходным алканом является н-гептан, то получится толуол:
2. Дегидрирование циклогексана и его производных над платиновым катализатором -другой промышленный способ:
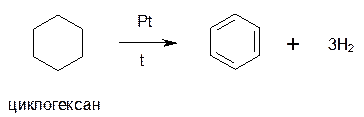
3. Циклотримеризация ацетиленанад раскалённым активированным углём - самая старая реакция получения бензола:

4. Гомологи бензола получают каталитическим алкилированиембензола алкенами или галогеналканами. Более подробно этот тип реакций будет разобран при изложении химических свойств аренов.
5. Лабораторный способ получения бензола, очень похожий на способ получения легких алканов, при котором соли органических кислот сплавляются с твердыми щелочами. Так, при сплавлении натриевой соли бензойной кислоты с гидроксидом натрия образуется бензол.

6.Еще одна реакция получения аренов в лаборатории весьма сходна с реакцией Вюрца. Она носит название реакция Вюрца-Фиттига и описывает образование гомологов бензола при обработке натрием галогенпроизводных бензола и галогеналканов
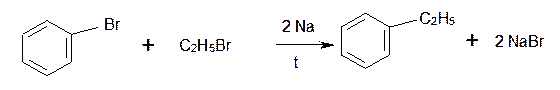
Правила ориентации в бензольном кольце
Данный эффект относится к многочисленным производным бензола. Заместители, в зависимости от вида содержащихся в них атомов, способны влиять на распределение электронной плотности в бензольном кольце. Несколько упрощая ситуацию, влияние заместителей можно свести к 2-м основным случаям.
Существуют заместители, увеличивающие электронную плотность в бензольном кольце (ориентантыI рода, электронодонорные заместители). К ним относятся: алкильные радикалы - СН3,- С2Н5,- ОН, -NН2.
Ориентанты 1 рода облегчают дальнейшее замещение в бензольном кольце
Замещение идет в орто- и пара- положения. К ориентантам 1 рода относятся также галогенные группы - Cl и -Br , но они затрудняют дальнейшее замещение.
Так, толуол алкилируется в присутствии катализатора AlCl3 с образованием смеси о- и п- ксилолов:
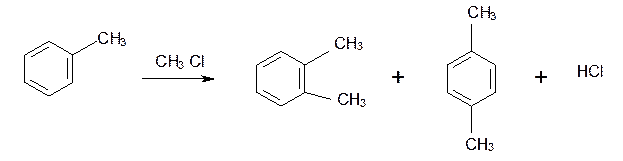
Наибольшей активностью обладают гидроксильная и аминная группы. Например, при обработке фенола (гидроксибензола) бромной водой происходит замещение водорода бромом и по орто- и по пара- положениям:
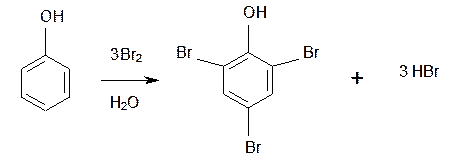
Другой вид заместителей – электроноакцепторных, уменьшающих электронную плотность в бензольном кольце – относят к ориентантамIIрода(нитрогруппа -NO2, карбоксильная -COOH, альдегидная -HCO и некоторые другие). Уменьшение электронной плотности происходит во всем бензольном кольце. В меньшей степени это относится к мета-положению, куда и направляется электрофильная частица.
При наличии ориентанта II рода дальнейшее замещение затрудняется.
В качестве примера приведем реакцию галогенирования нитробензола:

7.2.Химические свойства аренов
Шесть р-электронов бензольного кольца образуют единую устойчивую замкнутую π-систему, что делает ароматические соединения более стабильными и химически менее активными. Поэтому для аренов более характерны реакции электрофильного замещения при которых сохраняется ароматичность.
Необходимо отметить, что химические свойства гомологов бензола несколько отличаются от свойств самого бензола. Так, несмотря на явную непредельность структуры, бензол не реагирует с водой, галогеноводородами, бромной водой, водным раствором перманганата калия.