 |
|
Реакции по двойной связи
Жидкие жиры (растительные масла) содержат ненасыщенные карбоновые кислоты. Поэтому для них также характерны реакции присоединения по двойной связи.
а) Гидрогенизация жиров
При гидрировании жидкие жиры превращаются в твердые.

триолеат глицерина тристеарат глицерина
б) Взаимодействие с бромной водой

в) Присоединение галогеноводородов

г) Присоединение воды

12.3.Примеры решения задач
Пример 33. Некоторое количество смеси, содержащей 85%этилформиата и воду, обработали избытком натрия. При этом выделилось 4,48 л. газа (н.у). К такому же кол-ву исходной смеси добавили каплю серной кислоты и нагрели до установления равновесия, затем равновесную смесь охладили и также обработали натрием. При этом выделилось 6,72 л. газа (н.у.). Определить массовые доли веществ в равновесной смеси.
Решение:
1) В данной смеси с натрием реагирует только вода. Напишем уравнение реакции:
Н2О+Na  NaOH+0.5H2
NaOH+0.5H2
n(H2)=4,48/22,4=0,2 моль
2) Тогда n(H2O) в исходной смеси 0,2∙2 = 0,4(моль),
а масса воды в исходной смеси m(H2O)=0.4∙18=7,2 (г)
3) Масса исходной смеси m(смеси)=7,2/0,15 = 48 г,
а масса эфира в исходной смеси m(эфира)=48 – 7,2 = 40,8(г)
4) n(эфира) в исходной смеси n(эфира) = 40,8/74 = 0,55 (моль)
5) Уравнение реакции гидролиза эфира:
НСООС2Н5 + Н2О = НСООН + С2Н5ОН
было 0,55 0,4 0 0
прореаг. х х - -
в равн. 0,55-х 0,4-х х х
смеси
6) Напишем уравнения реакций взаимодействия компонентов равновесной
смеси с натрием
Н2О + Na  NaOH + 0,5 Н2
NaOH + 0,5 Н2
0,4-x 0,2-0,5x
HCOOH +Na  HCOONa + 0.5 Н2
HCOONa + 0.5 Н2
x 0,5x
C2H5OH + Na  C2H5ONa +0,5H2
C2H5ONa +0,5H2
x 0,5x
7) Количество выделившегося водорода по условию задачи:
n(H2) =6,72/22,4 = 0,3;
Это равно 0,2 -0,5x + 0,5x +0,5x = 0,2 + 0,5x
Следовательно 0,2+0,5x = 0,3, откуда х=0,2
8) Тогда количество веществ в равновесной смеси:
n(эфира) = 0,55 – 0,2 = 0,35(моль)
n(воды) = 0,4 – 0,2 = 0,2(моль)
n(кислоты) = 0,2(моль)
n(спирта) = 0,2(моль)
9) Массы веществ в равновесной смеси:
m(эфира) = 0,35∙74 = 25,9(г), m(воды) = 18∙0,2 = 3,6(г).
m(кислоты) = 46∙0,2 = 9,2(г), m(спирта) = 46∙0,2 = 9,2(г).
10) Массовые доли веществ в равновесой смеси:
ω(эфира) =25,9: 48 =0,5396; ω( воды) = 3,6:48 =0,075;
ω (кислоты) = ω (спирта) = 9,2:48 =0,1916.
Ответ: ω(эфира) =0,5396; ω(воды) = 0,075;
ω(кислоты) =ω(спирта) = 0,1916.
12.4.Задачи и упражнения для самостоятельного решения
382.Напишите структурную формулу 2-метилпропилпропионата.
383. Напишите структурную формулу сложного эфира
СН3СН2СООСН2СН2СН3.
384.Составьте уравнения реакций получения эфиров:
а)метилформиата; б)этилпропионата;
в)пропилпропионата; г)пропилформиата.
385.Напишите уравнения реакций,
при помощи которых можно осуществить следующие превращения:
а) СН2=СН2  СН3СООС2Н5
СН3СООС2Н5  С2Н5ОН
С2Н5ОН  СН2=СН2
СН2=СН2
б) С2Н2  СН3ОН
СН3ОН  С2Н5ОН
С2Н5ОН  СН3СООН
СН3СООН 
СН3СООСН3
в) С3Н8  С3Н7Сl
С3Н7Сl  C3H7OH
C3H7OH  C2H5COH
C2H5COH 
C2H5COOH  C2H4BrCOOH
C2H4BrCOOH  С2Н4ОНСООН
С2Н4ОНСООН 
C2H4ОНCOOC3H7;
386. Из 1-хлорпропана, не используя других углеродсодержащих
соединений, получите изопропиловый эфир пропионовой кислоты.
387.Опишите процессы, происходящие при добавлении в раствор фенола в пропилацетате избытка щелочи, последующем нагревании смеси и обработке её бромоводородной кислотой до окончания всех реакций.
388.Напишите структурную формулу сложного эфира, образованного
глицерином :
а) с пальмитиновой, стеариновой и масляной кислотами;
б )с олеиновой,линолевой и линоленовой кислотами.
389.Напишите уравнения реакций гидролиза этилформиата в кислой и щелочной средах.
390. Напишите уравнения реакций восстановления водородом:
а) метилпропионата; б) этилацетата,
391.Напишите уравнения реакций гидролиза тристеарата в кислой и
щелочной средах.
392.Напишите уравнение реакции гидрогенизации триолеата глицерина.
393.Опишите процессы, протекающие при добавлении избытка бромной воды в смесь акриловой кислоты и жира, содержащего два остатка олеиновой кислоты и один остаток линолевой, и последующей обработки полученной смеси избытком водного раствора щелочи при кипячении.
394.Органическое соединение содержит 48,65% углерода , 8,11% -водорода, 43,24 % - кислорода. Определить формулу этого вещества, если известно, что его молекулярная масса = 74 г/моль. Составьте структурные формулы изомеров этого соединения.
395.В результате полного гидрирования смеси жиров, содержащих только остатки пальмитиновой и линолевой кислот было получено 788.4 г твердого вещества, При этом было затрачено 100.82 л водорода (н.у.). Полученное вещество при нагревании обработали 1.82 л раствора гидроксида натрия с массовой долей щелочи 10% и с плотностью 1.1 г/мл. Определите массовые доли вещества в полученной смеси.
396.При гидролизе 31,2 г сложного эфира этиленгликоля получено 18 г предельной одноосновной кислоты, на нейтрализацию которой пошло
120 г 10%-ного водного раствора гидроксида натрия. Установите формулу исходного сложного эфира.
397.Сколько г сложного эфира СН3СООСnH2n+1 получится из 13,8 г спирта и избытка уксусной кислоты , если при действии избытка натрия на 22,6 г. Этого спирта выделилось 6, 72 л. (н.у.) водорода (выход =100%), а в выход реакции этерификации = 50%).
398.Некоторое количество смеси, содержащей этилацетат и 10% воды, обработали избытком натрия. При этом выделилось 3,92 л. газа (н.у). К такому же кол-ву исходной смеси добавили каплю серной кислоты и нагрели до установления равновесия, затем равновесную смесь охладили и также обработали натрием. При этом выделилось 7,28 л. газа (н.у.). Определите массовые доли веществ в равновесной смеси.
399.При нагревании 36,4 г. смеси этанола и этановой кислоты в присутствии серной кислоты образовалось 26,4 г. сложного эфира. Исходную смесь сожгли в избытке кислорода. Продукты сгорания пропустили через раствор гидроксида кальция, при этом образовалось
140 г осадка. Определите состав исходной смеси и выход реакции этерификации.
400. Водный раствор стеарата калия массой 150 г с массовой долей растворенного вещества 6% обработали 100 мл 0,2 М соляной кислоты. Вычислите массу образовавшегося осадка.
401. Какая масса глицерина образуется при щелочном гидролизе
331,5г триолеата?
402.При гидролизе 356 г жира, образованного одной карбоновой кислотой, образовалось 36,8 г глицерина. Установите структурную формулу жира. Напишите уравнения реакций и укажите условия их протекания.
403.Относительная плотность паров сложного эфира по водороду равна 30. Приведите структурную формулу этого эфира.
404.Плотность паров сложного эфира по гелию равна 22. При сгорании всей получившейся в результате гидролиза кислоты образуется углекислого газа больше, чем при сгорании получившегося в ходе той же реакции спирта. Установите структурную формулу этого эфира.
405.Для гидролиза смеси этилацетата и метилпропианата потребовалось
120 г 20%-ного раствора карбоната калия. Вычислите массу смеси.
406.Жир массой 44,5 г, представляющий собой триглицерид одной предельной органической кислоты, нагрели с 70 мл 20%-ного раствора гидроксида натрия (плотность 1,2 г/мл) . Для нейтрализации избытка щелочи потребовалось 22,5 мл 36,5%-ной соляной кислоты (плотность 1,2 г/мл). Установите структурную формулу жира.
407.Для полного омыления 42,6 г растительного масла потребовалось50 г 12,0% - ного раствора гидроксида натрия. При последующей обработке раствора избытком бромной воды получена смесь тетрабромпроизводного и дибромпроизводного в молярном соотношении 2:1, причем массовая доля натрия в одном из бромпроизводных составляет 3,698%.Установите возможную формулу жира.
408. Какая масса глицерида уксусной кислоты получится при взаимодействии уксусной кислоты с избытком глицерина, если при действии соды на такое же количество уксусной кислоты образуется 6,72л(н.у.)СО2?
409. Некоторое количество смеси, содержащей 80,4% метилового эфира пропионовой кислоты и воду, обработки избытком металлического натрия. При этом выделилось 2.24 л газа (н.у.). К такому же количеству исходной смеси добавили каплю серной кислоты и нагрели до установления равновесия, затем равновесную смесь охладили и так же обработали избытком натрия, при этом выделилось 3,36 л газа (н,у.). Определите массовые доли веществ в равновесной смеси (реакцией натрия с серной кислотой пренебречь).
Глава 13. УГЛЕВОДЫ
Углеводы- класс природных соединений, включающий простые углеводы (моносахариды) и сложные. Моносахариды являются гетерофункциональными соединениями, в молекулах которых одновременно содержатся карбонильная (альдегидная или кетонная) и несколько гидроксильных групп. Большинство этих веществ имеет состав, соответсвующей общей формуле CnH2nOn.Наиболее распространены в природе пентозы(5 углеродных атомов) и гексозы(6 углеродных атомов). Все моносахариды имеют один или несколько асимметрических атомов углерода и поэтому имеют стереоизомеры( D и L). Нумерация цепи в углеводах начинается от атома углерода карбонильной группы или от того атома углерода, к которому она ближе находится.
Примеры стереоизомеров глюкозы и фруктозы:

D-глюкоза L-глюкоза D-фруктоза L-фруктоза
Моносахариды в растворе присутствуют в основном не в открытой (линейной) форме, а в циклической, которая является продуктом взаимодействия спиртового гидроксила и карбонильной группы. Таким образом, моносахариды представляют собой циклические полуацетали- пяти или шестичленные. Например, циклические формы β-рибозы и β-дезоксирибозы , входящие в состав нуклеиновых кислот:

β - рибоза β - дезоксирибоза
Сложные углеводы – углеводы, способные гидролизоваться с образованием простых углеводов. Сложные углеводы подразделяются на олигосахариды и полисахариды. Олигосахариды при гидролизе дают несколько молекул моносахаридов, полисахариды-множество таких молекул. Важнейшими олигосахаридами являются дисахариды. Наибольшее значение из дисахаридов имеет сахароза – свекловичный или тростниковый сахар С12Н22О11, который при гидролизе даёт глюкозу и фруктозу. Полисахариды – это сложные сахара, каждая молекула которых при гидролизе распадается на большое число молекул моносахаридов(от 30 тысяч до 400 миллионов).Состав полисахаридов можно выразить формулой (С6Н10О5)n. Все они состоят из остатков молекул глюкозы, соединённых друг с другом. Наибольшее значение из полисахаридов имеют крахмал( полимер α– глюкозы) и целлюлоза( полимер β – глюкозы)
13.1. Химические свойства углеводов
Для глюкозы характерны многие реакции простых альдегидов.
Окисление
а) При окислении мягкими окислителями (бромная вода) получается глюконовая кислота
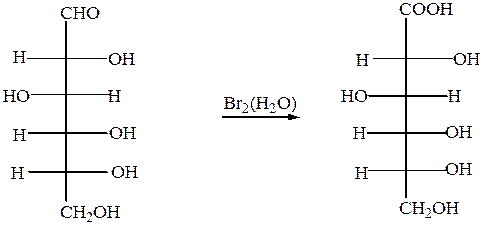
D- глюкоза D- глюконовая кислота
Подобно обычным альдегидам моносахариды, в частности, глюкоза, легко окисляются аммиачным раствором оксида серебра [Ag(NH3)2]OH , проявляя, таким образом, сильную восстанавливающую способность( реакция «серебряного зеркала»).
(C5H11O5)CH=O + 2[Ag(NH3)2]OH 
(C5H11O5)COONH4 + 2Ag↓ + 3NH3 + H2O
б) С помощью сильного окислителя (разбавленной азотной кислотой) окисляется вместе с альдегидной группой спиртовая группа, которая находится в конце цепи. При этом образуется сахарная кислота
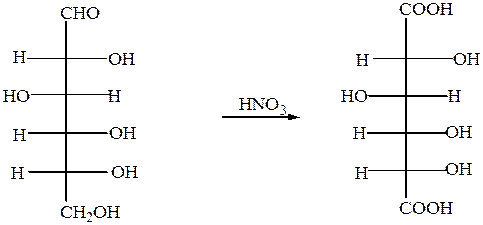
глюкоза сахарная кислота
Восстановление
При восстановлении с помощью водорода в присутствии катализаторов гидрирования(никель) образуется шестиатомный спирт глюцит(сорбит):
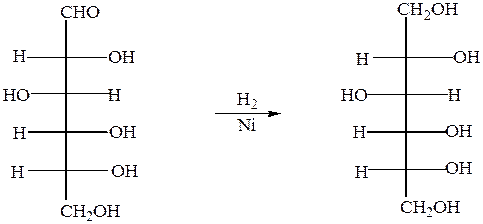
глюкоза сорбит
Алкилирование
При взаимодействия спиртовых групп моносахаридов алкилгалогенидами образуются простые эфиры:

Ацилирование
При взаимодействии моносахаридов с уксусным ангидридом образуются сложные эфиры с участием всех гидроксильных групп,например:

Брожение гексоз
Брожение – сложный биохимический процесс под влиянием различных ферментов.
а) спиртовое
С6Н12О6  2С2Н5ОН + 2СО2
2С2Н5ОН + 2СО2
б) маслянокислое
С6Н12О6  СН3СН2СН2СООН + 2СО2 + 2Н2
СН3СН2СН2СООН + 2СО2 + 2Н2
в) молочнокислое
С6Н12О6  2СН3СН(ОН)СООН
2СН3СН(ОН)СООН
6. Химические свойства целлюлозы определяются прежде
всего присутствием гидроксильных групп. За счёт этих групп целлюлоза даёт простые и сложные эфиры. Например:
[C6H7O2(OH)3]n + 3nHNO3(H2SO4)  [C6H7O2(ONO2)3] + 3nH2O
[C6H7O2(ONO2)3] + 3nH2O
тринитроцеллюлоза
7. Реакция, характерная для многоатомных спиртов-комплексообразование с гидроксидом меди(II) на холоду(интенсивное синее окрашивание).
13.2.Примеры решения задач
Пример 34.При маслянокислом брожении глюкозы образовалось 13,44л(н.у.)
смеси газообразных веществ. Выход в реакции брожения составил 60%. Какая
масса глюкозы была взята для брожения?
Решение:
1) Напишем уравнение реакции
С6Н12О6  С3Н7СООН + 2СО2 + 2Н2
С3Н7СООН + 2СО2 + 2Н2
2) Определяем количество вещества газообразных продуктов
n = 13,44/22,4 = 0,6 моль
3) Для образования 0,6 моль газов(0,3 моль СО2 и 0,3 моль Н2)
в соответствии с уравнением реакции прореагировало 0,15 моль глюкозы.
4) С учётом выхода глюкозы необходимо 0,15/ 0,6 = 0,25 моль
Масса глюкозы m(глюкозы) = 0,25∙180 = 45 г
Ответ: 45 г
Пример 35. Целлюлозу обработали нитрующей смесью(HNO3 и H2SO4), в
результате был получен тринитрат целлюлозы. При этом масса нитрующей
смеси уменьшилась на 108 г. Определите массу полученной
тринитроцеллюлозы (выход 100%).
Решение:
1) Напишем уравнение реакции
[C6H7O2(OH)3]n + 3nHNO3  [C6H7O2(ONO2)3]n + 3nH2O
[C6H7O2(ONO2)3]n + 3nH2O
х 3х х 3х
2) Пусть прореагирует х моль целлюлозы
Тогда в соответствии с уравнением реакции масса нитрующей смеси
уменьшится на 3х∙63 и увеличится на 3х∙18.
3) Итого, общий баланс 3х∙63 – 3х∙18 = 3х(63-18) = 135х, что составляет в
соответствии с условием 108 г.
Тогда 108 = 135х. Откуда х= 0,8(моль)
4) Масса тринитроцеллюлозы равна
0,8∙М(C6H7O2(ONO2)3 = 0.8∙297 = 237,6(г).