 |
|
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
СБОРНИК ЛАБОРАТОРНЫХ РАБОТ ПО ФИЗИКЕ
МОЛЕКУЛЯРНАЯ ФИЗИКА
Рецензент: Гервидс В.И.
(кафедра общей физики МИФИ)
Озерск
2000 г.
УДК 535
Лисицын С.Г, Мосунов С.Е. Оконников Е.Г,
Сборник лабораторных работ по физике. Молекулярная физика.
Озерский технологический институт МИФИ (ОТИ МИФИ), 2000 г.
СОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ...............................................................................................
МЕТОДИЧЕСКИЕ УКАЗАНИЯ.......................................................................
ЯВЛЕНИЯ В ГАЗАХ.........................................................................................
РАБОТА № 21
ОПРЕДЕЛЕНИЕ ТЕРМИЧЕСКОГО КОЭФФИЦИЕНТА ДАВЛЕНИЯ ВОЗДУХА ПРИ ПОМОЩИ ГАЗОВОГО ТЕРМОМЕТРА............................................
ОПИСАНИЕ УСТАНОВКИ И МЕТОДИКА ИЗМЕРЕНИЙ.......................
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
РАБОТА № 22
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ СР/СV ДЛЯ ВОЗДУХА МЕТОДОМ КЛЕМАНА–ДЕЗОРМА.........................................................................................................
МЕТОДИКА ИЗМЕРЕНИЙ СР/СV И ОПИСАНИЕ УСТАНОВКИ.............
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
РАБОТА № 23
ИЗУЧЕНИЕ РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА НА МЕХАНИЧЕСКОЙ МОДЕЛИ............................................................................................................................
ОПИСАНИЕ УСТАНОВКИ И МЕТОДИКА ИЗМЕРЕНИЙ.......................
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
ПРИЛОЖЕНИЕ...............................................................................................
СВЯЗЬ ПАРАМЕТРОВ РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА С ГЕОМЕТРИЕЙ ДОСКИ ГАЛЬТОНА....................................................................................................
ВЯЗКОСТЬ ГАЗОВ И ЖИДКОСТЕЙ..........................................................
РАБОТА № 24
ОПРЕДЕЛЕНИЕ ВЯЗКОСТИ ВОЗДУХА ПО ИСТЕЧЕНИЮ ИЗ КАПИЛЛЯРА
МЕТОДИКА ИЗМЕРЕНИЙ И ОПИСАНИЕ УСТАНОВКИ.......................
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
РАБОТА № 25
ОПРЕДЕЛЕНИЕ ВЯЗКОСТИ ЖИДКОСТИ КАПИЛЛЯРНЫМ ВИСКОЗИМЕТРОМ ПИНКЕВИЧА..................................................................................................
МЕТОДИКА ИЗМЕРЕНИЙ И ОПИСАНИЕ ПРИБОРА.............................
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
РАБОТА № 26
ОПРЕДЕЛЕНИЕ ВЯЗКОСТИ ЖИДКОСТИ МЕТОДОМ СТОКСА.......
ОПИСАНИЕ МЕТОДА СТОКСА ОПРЕДЕЛЕНИЯ ВЯЗКОСТИ ЖИДКОСТИ.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
ПРИЛОЖЕНИЕ...............................................................................................
ПАДЕНИЕ ШАРИКА В ВЯЗКОЙ СРЕДЕ...................................................
ТЕПЛОВЫЕ ЯВЛЕНИЯ В ТВЕРДЫХ ТЕЛАХ И ЖИДКОСТЯХ............
РАБОТА № 27
ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОЕМКОСТИ ТВЕРДЫХ ТЕЛ КАЛОРИМЕТРИЧЕСКИМ МЕТОДОМ.....................................................
МЕТОДИКА ИЗМЕРЕНИЙ И ОПИСАНИЕ УСТАНОВКИ.......................
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
РАБОТА № 28
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ЛИНЕЙНОГО РАСШИРЕНИЯ ТВЕРДЫХ ТЕЛ....................................................................................................................
МЕТОДИКА ИЗМЕРЕНИЙ И ОПИСАНИЕ УСТАНОВКИ.......................
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
РАБОТА № 29
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ ТВЕРДЫХ ТЕЛ......
МЕТОДИКА ИЗМЕРЕНИЙ И ОПИСАНИЕ УСТАНОВКИ.......................
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
РАБОТА № 30
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ ТВЕРДЫХ ТЕЛ
МЕТОДИКА ИЗМЕРЕНИЙ И ОПИСАНИЕ УСТАНОВКИ.......................
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
РАБОТА № 31
ИЗУЧЕНИЕ ПРОЦЕССА ИСПАРЕНИЯ ВОДЫ.......................................
ВВЕДЕНИЕ....................................................................................................
ОПИСАНИЕ УСТАНОВКИ И МЕТОДИКА ИЗМЕРЕНИЯ УДЕЛЬНОЙ ТЕПЛОТЫ ИСПАРЕНИЯ.................................................................................................
ПОРЯДОК ИЗМЕРЕНИЯ УДЕЛЬНОЙ ТЕПЛОТЫ ИСПАРЕНИЯ ВОДЫ
МЕТОДИКА ИЗМЕРЕНИЯ СКАЧКА ТЕМПЕРАТУРЫ НА СВОБОДНОЙ ПОВЕРХНОСТИ ВОДЫ И ОПИСАНИЕ УСТАНОВКИ............................
ПОРЯДОК ИЗМЕРЕНИЯ СКАЧКА ТЕМПЕРАТУРЫ НА СВОБОДНОЙ ПОВЕРХНОСТИ ВОДЫ................................................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ.............................................................
РАБОТА №32
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ МЕТОДОМ ВЗВЕШИВАНИЯ КАПЕЛЬ.....................................................
МЕТОДИКА ИМЕРЕНИЙ И ОПИСАНИЕ УСТАНОВКИ.........................
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
РАБОТА № 33
ОПРЕДЕЛЕНИЕКОЭФФИЦИЕНТА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ЖИДКОСТИ ПО ВЫСОТЕ ПОДНЯТИЯ В КАПИЛЛЯРАХ..................
МЕТОДИКА ИЗМЕРЕНИЙ И ОПИСАНИЕ КАТЕТОМЕТРА..................
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
РАБОТА № 34
ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ КОЭФФИЦИЕНТА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ОТ ТЕМПЕРАТУРЫ И КОНЦЕНТРАЦИИ РАСТВОРЕННЫХ В ВОДЕ СОЛЕЙ..................................................................................................
МЕТОДИКА ИЗМЕРЕНИЙ И ОПИСАНИЕ УСТАНОВКИ.......................
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.........................................................
КОНТРОЛЬНЫЕ ВОПРОСЫ........................................................................
ЛИТЕРАТУРА.................................................................................................
ПРЕДИСЛОВИЕ
Настоящее руководство предназначено для использования студентами ОТИ МИФИ на лабораторных занятиях по физике по разделу «Молекулярная физика».
При подготовке руководства использованы материалы «Физического практикума» МГУ под редакцией В. И. Ивероновой, М., Физматгиз, 1968»; «Руководства к лабораторным занятиям» под редакцией Л. Л. Гольдина, М., Наука, 1973. Основой для составления руководства послужил ныне используемый в ОТИ МИФИ сборник лабораторных работ по молекулярной физике Лисицына С.Г., Оконникова Е.Г. и Синяпкиной Г.И.
Сборник разбит на разделы, в которые включены работы по изучению идеальных газов, вязкости жидкостей и газов, тепловым свойствам твердых тел, поверхностному натяжению и другим темам.
Чтобы избежать повторения однотипных теоретических сведений, все эти сведения излагаются во введении к каждому разделу. Изложение теории носит, в основном, конспективный характер, чтобы не дублировать содержание стандартных учебников. Список литературы – общий для всех работ приведен в конце данного сборника. Список литературы не является сколько-нибудь исчерпывающим, в него включены лишь те учебники, которые в заметном количестве имеются в библиотеке ОТИ МИФИ.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Приступая к выполнению лабораторных работ, необходимо внимательно ознакомиться с устройством установки, на которой предстоит проводить измерения и отчетливо представлять себе порядок выполнения работы. Необходимо при этом все действия с установками производить аккуратно и осторожно, так как многие установки – стеклянные, кроме того, неаккуратность в работе может привести к загрязнению установок, что также приводит к выходу их из строя.
В ходе измерений необходимо систематически вести запись результатов в лабораторную тетрадь. Для этого перед началом измерений в тетрадь рекомендуется начертить таблицы, форма которых указана в описаниях к лабораторным работам. Графики рекомендуется выполнять на миллиметровой бумаге.
При подсчете погрешностей измерений необходимо пользоваться методикой, изложенной в руководстве по разделу «Механика».
Теоретические сведения, приведенные в руководстве, как правило, весьма краткие и не заменяют учебника. При подготовке к занятиям необходимо пользоваться учебниками, список которых приведен в конце настоящего руководства.
ЯВЛЕНИЯ В ГАЗАХ
(введение к работам №21-23)
Основной особенностью газов является их малая плотность, благодаря чему среднее расстояние между молекулами оказывается во много раз больше размеров молекул. Поскольку радиус межмолекулярного взаимодействия также имеет порядок размера молекул, то, вследствие этого, взаимодействие между молекулами оказывается очень слабым, и при рассмотрении многих свойств газов им можно вообще пренебречь. Модель газа, в которой пренебрегают взаимодействием между молекулами, носит название идеального газа.
Идеальный газ подчиняется, как известно, уравнению состояния
PV=NkT (1)
где P, V, T - давление, объем, температура газа, N - число молекул газа в объеме V, k=1,38×10-23 Дж/К – постоянная Больцмана.
Это уравнение часто записывается в другой форме
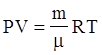 (2)
(2)
где m - масса газа, заключенного в объеме V, R =8,314 Дж/моль×К – универсальная газовая постоянная, m - масса моля этого газа.
Уравнение (2) носит название уравнения Клапейрона – Менделеева.
Для постоянной массы газа, как видно из (1) или (2), если:
1) T=const, то PV=const - закон Бойля – Мариотта,
2) P=const, то V/T=const - закон Гей – Люссака,
3) V=const,то P/T=const - закон Шарля.
Закон Шарля можно записать в виде
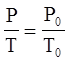 (3)
(3)
где T0=273,15 K (00 C), а P0 - давление газа при этой температуре. Если записать абсолютную температуру T в виде:
T=273,15+t
где t - температура по шкале Цельсия, то из (3) следует:
P=P0×(1+ap×t) (4)
где величина ap=1/273 град-1 - термический коэффициент давления идеального газа.
Ввиду того, что в идеальном газе взаимодействие между молекулами отсутствует, его внутренняя энергия определяется только кинетической энергией молекул газа и, в случае многоатомных газов, энергией колебаний атомов, составляющих молекулы. Согласно теореме о распределении энергии по степеням свободы молекул, на каждую из степеней свободы поступательного и вращательного движений приходится по kТ/2 тепловой энергии, поэтому внутренняя энергия идеального газа
 (5)
(5)
где N - число молекул в газе, i - число поступательных и вращательных степеней свободы молекулы газа.
В многоатомных газах сюда необходимо добавить еще энергию колебаний атомов, составляющих молекулы. Следует при этом отметить, что при температурах порядка комнатной, эта энергия в большинстве случаев не зависит от температуры. Это есть следствие того, что колебания атомов в многоатомных молекулах подчиняются законам квантовой, а не классической механики. Вращательное и поступательное движение молекул подчиняются законам классической механики вплоть до достаточно низких температур. Таким образом, можно написать:
 (5’),
(5’),
где E0 – не зависящая от температуры энергия колебаний атомов, составляющих молекулы.
Из (5’) следует, что энергия моля (N = NA) газа:
 (6).
(6).
Теплоемкость моля при постоянном объеме:
 (7)
(7)
теплоемкость при постоянном давлении:
 (8)
(8)
где W = E+PV – энтальпия моля газа. Как видим, колебательное движение при этих условиях не вносит вклада в теплоемкость газов, поэтому его в большинстве случаев можно не учитывать вовсе.
В теории газов важную роль играет величина  , называемая показателем адиабаты. Как видно из (7) и (8) она связана с числом степеней свободы молекулы соотношением:
, называемая показателем адиабаты. Как видно из (7) и (8) она связана с числом степеней свободы молекулы соотношением:
 (9)
(9)
Хотя в модели идеального газа полностью пренебрегается взаимодействие между молекулами, в действительности молекулы газа изредка сталкиваются друг с другом, и эти столкновения существенны для установления определенного состояния газа. Именно наличие соударений приводит к установлению определенной температуры и давления газа. Соударения между молекулами приводят также к тому, что скорость каждой молекулы случайным образом изменяется со временем. Однако, благодаря этой случайности в системе большого числа молекул устанавливается вполне определенное распределение скоростей молекул. А именно, если в сосуде имеется N молекул, и через dN (vx, vy, vz) мы обозначим число молекул, проекции скоростей которых на оси OX, OY и OZ заключены в пределах от vx до vx+dvx, от vy до vy+dvy, и от vz до vz+dvz соответственно, то для dP=dN/N справедливо выражение:
 (10),
(10),
где m - масса молекулы, Т – абсолютная температура.
dP это вероятность того, что проекции скорости молекулы окажутся в интервале скоростей от vx до vx+dvx, от vy до vy+dvy, и от vz до vz+dvz соответственно.
Функция
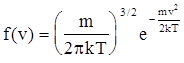 (11)
(11)
носит название функции распределения Максвелла. Эту функцию можно записать как произведение трех функций, каждая из которых зависит лишь от одной компоненты скорости (vx, vy или vz):
f(  j(vx)×j(vy)×j(vz)
j(vx)×j(vy)×j(vz)
 (12)
(12)
Функции j(vi) (i=x,y,z) называются одномерными функциями распределения Максвелла или функциями распределения по компонентам скорости. Величины
dn(vi)=j(vi)×dvi
имеют смысл доли от полного количества частиц, у которых компонента скорости vi лежит внутри интервала (vi, vi+dvi).

|
Распределению Максвелла можно придать более наглядный смысл, если воспользоваться понятием пространства скоростей. Для этого по осям прямоугольной системы координат отложим для каждой молекулы значения ее проекции скорости на соответствующее направление. Тогда каждой молекуле будет сопоставлена точка в пространстве скоростей, координаты которой совпадают с проекциями скорости этой точки vx, vy, vz.. Вместо указания координат точки можно указать ее радиус-вектор, так и в нашем случае положение точки в пространстве скоростей можно задать, указав вектор скорости молекулы, соответствующей этой точке. Таким образом, в пространстве скоростей мы получим множество точек, число которых совпадает с числом молекул. Каждая из этих точек есть по существу конец вектора скорости соответствующей молекулы. Подобно молекулам эти точки движутся, т.к. скорости молекул непрерывно изменяются. Однако, среднее число точек, находящихся внутри какого-либо малого параллелепипеда с длинами ребер dvx, dvy, dvz остается с течением времени неизменным, если при этом остается неизменной температура. Это число можно записать как произведение плотности числа точек в том месте пространства скоростей, где расположен этот параллелепипед, на его объем, равный dvx×dvy×dvz. Положение параллелепипеда в пространстве скоростей однозначно задается указанием вектора скорости, направленного в одну из вершин параллелепипеда (см. рис. 1). Таким образом, согласно (10) и (11), произведение функции распределения Максвелла  на число молекул есть плотность числа точек внутри параллелепипеда, изображенного на рис.1.
на число молекул есть плотность числа точек внутри параллелепипеда, изображенного на рис.1.
Помимо распределения Максвелла (10) по проекциям вектора скорости  можно найти также распределение по модулю скорости v. При этом направлением движения частиц не интересуются. Распределение Максвелла по модулю скорости определяется формулой:
можно найти также распределение по модулю скорости v. При этом направлением движения частиц не интересуются. Распределение Максвелла по модулю скорости определяется формулой:
 (13).
(13).

|
Здесь F(v) - функция распределения по модулю скорости. Найти эту функцию можно с помощью (10), если определить число молекул с заданным значением модуля скорости и произвольными направлениями движения. Очевидно, что в пространстве скоростей все такие молекулы (точнее, точки, им соответствующие) попадают внутрь сферического слоя радиуса v и толщиной dv (см. рис. 2). Тогда легко находим:
 (13)
(13)
На рис.3 представлен график функции распределения F(v), а на рис. 4 - график функции распределения по проекции скорости j(vi) (на графике x=  )
)
Величина 2kT/m имеет размерность квадрата скорости:  . Эта скорость носит название наиболее вероятной скорости молекул. Это название обусловлено тем, что при v=vвер функция F(v) достигает максимума, т.е. такую величину скорости (и близкую к ней) имеет наибольшее количество частиц газа.
. Эта скорость носит название наиболее вероятной скорости молекул. Это название обусловлено тем, что при v=vвер функция F(v) достигает максимума, т.е. такую величину скорости (и близкую к ней) имеет наибольшее количество частиц газа.
С помощью функции распределения Максвелла можно найти среднее значение любой физической величины q(vx,vy,vz), зависящей от скорости:

В частности, для среднего значения модуля скорости:

и среднего квадрата скорости:
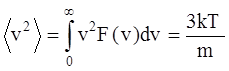 .
.
Здесь m – масса молекулы.

Отметим еще один важный факт. Распределение Максвелла имеет место не только в газах, но в любой системе частиц, движение которых подчиняется законам классической механики. В газах, как было отмечено, поступательное движение молекул полностью подчиняется законам классической механики (обычно говорят, что оно классично), поэтому распределение молекул по скоростям является максвелловским. Колебания атомов в кристаллической решетке твердых тел отнюдь не всегда являются классичными при комнатных температурах, при низких же температурах (Т£10-100К) эти колебания совершенно перестают быть классичными. Соответственно, и распределение атомов решетки по скоростям также становится немаксвелловским. Движение электронов проводимости в металлах подчиняется законам квантовой механики вплоть до температур в несколько тысяч градусов, потому распределение электронов проводимости в металлах по скоростям также немаксвелловское.
РАБОТА № 21