 |
|
Рівняння стану ідеального газу (рівняння Клапейрона-Менделєєва)
Виведення рівняння стану ідеального газу. Універсальна газова стала
Виведення рівняння стану ідеального газу. Стан газу певної маси повністю визначений, якщо відомі тиск, температура і його об’єм. Ці величини називають параметрами стану газу. У природі часто відбуваються процеси, коли одночасно змінюються усі три величини, що характеризують стан газу. Рівняння стану ідеального газу – це рівняння, що поєднує параметри стану цього газу –  . Рівняння стану ідеального газу є узагальненням дослідних фактів. Його нині можна вивести з основного рівняння МКТ у вигляді
. Рівняння стану ідеального газу є узагальненням дослідних фактів. Його нині можна вивести з основного рівняння МКТ у вигляді
 →
→  →
→  →
→  .
.
Добуток відомих вам сталої Авогадро 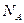 на сталу Больцмана
на сталу Больцмана  є сталою величиною, яку називають універсальною (молярною) газовою сталою і позначають як
є сталою величиною, яку називають універсальною (молярною) газовою сталою і позначають як  . Підрахуємо значення універсальної газової сталої
. Підрахуємо значення універсальної газової сталої 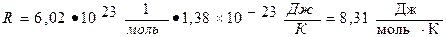 .
.
Остаточно знаходимо рівняння, яке містить тільки макроскопічні характеристики газу і є результатом основного рівняння МКТ газів. Це рівняння називають рівнянням стану ідеального газу або рівнянням Клапейрона-Менделєєва:
 . (5.9)
. (5.9)
Рівняння Клапейрона-Менделєєва є загальним рівнянням стану ідеального газу будь-якого хімічного складу і довільної маси m. Єдина величина у цьому рівнянні, що залежить від виду газу, – це його молярна маса μ.
Для 1 моля ідеального газу рівняння набуде вигляду:
 ,
,
де Vμ – об’єм 1 моля газу, або молярний об’єм.
Для довільної кількості молів молекул газу 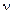 :
:
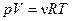 .
.
Якщо врахувати, що густина газу ρ =  , то рівняння Клапейрона-Менделєєва матиме вигляд:
, то рівняння Клапейрона-Менделєєва матиме вигляд:
р = 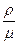 RT
RT
Газ сталої маси може перебувати в різних станах із різними параметрами:  ;
;  .
.
Праві частини обох виразів однакові. Порівнюючи їх ліві частини, отримаємо рівняння, справедливе для газу незмінної маси:
 або
або 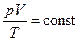 . (5.10)
. (5.10)
Рівняння стану ідеального газу (5.10) виведене у 1834 р. французьким фізиком Клапейроном.Вононазивається рівнянням Клапейрона (об’єднаним газовим законом) і формулюється так: під час переходу газу незмінної маси з одного стану в інший добуток його тиску на об’єм, поділений на термодинамічну температуру газу, є величиною сталою.
У 1874 р. видатний російський учений Д. І. Менделєєв удосконалив формулу (5.10), ввівши макроскопічний параметр – масу. Тому рівняння (5.9) називають рівнянням Клапейрона-Менделєєва.
Рівняння стану дає змогу визначити:
• одну з макроскопічних величин (  ), знаючи дві інші;
), знаючи дві інші;
• перебіг процесів у системі;
• зміну стану системи під час виконання нею роботи або отримання теплоти від тіл, які її оточують.
Експериментально підтвердити рівняння стану у вигляді  можна за допомогою установки для перевірки газових законів, основною частиною якої є сильфон – тіло змінного об’єму(мал. 5.17).
можна за допомогою установки для перевірки газових законів, основною частиною якої є сильфон – тіло змінного об’єму(мал. 5.17).
Лише за тиску у сотні атмосфер (коли виявляє себе об’єм молекул газу) та за температур зрідження газу (внаслідок великої сили взаємодії молекул) відхилення від результатів розрахунків за рівнянням стану ідеального газу стають істотними.
? Запитання для самоперевірки
1. Що таке параметри стану системи? Які величини до них належать?
2. Наведіть рівняння стану системи.
3. Виведіть рівняння Клапейрона-Менделєєва для довільної маси ідеального газу.
4. Як записати рівняння стану для одного моля ідеального газу?
5. Виведіть рівняння Клапейрона. Як воно формулюється?
6. Чому дорівнює об’єм одного моля будь-якого газу за нормальних умов?
7. Чому дорівнює універсальна газова стала в СІ?