 |
|
Газові закони для ізопроцесів
Ізотермічний процес. Закон Бойля – Маріотта . Ізобарний процес. Закон Гей-Люссака. Ізохорний процес. Закон Шарля.
Ізотермічний процес. Закон Бойля – Маріотта. За допомогою рівняння стану ідеального газу можна досліджувати процеси, в яких маса газу і один із трьох параметрів залишаються незмінними. Процес – це перехід системи з одного стану в інший. Кількісні залежності між двома параметрами газу за фіксованого значення третього параметра називають газовим законом. Процеси, які відбуваються за незмінного значення одного з параметрів ідеального газу сталої маси m і певного сорту μ називають ізопроцесами(від грец. ізос – рівний, однаковий). Оскільки жоден із параметрів газу не може бути суворо фіксованим, то ізопроцес – це ідеалізована модель стану ідеального газу.
Розглянемо процес, що відбувається за сталої температури. Процес зміни стану термодинамічної системи за сталої температури називають ізотермічним (  ,
, 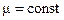 ,
,  ). Якщо до ізотермічного процесу застосувати рівняння стану у вигляді (5.9), то, з урахуванням сталості температури, воно набуде вигляду:
). Якщо до ізотермічного процесу застосувати рівняння стану у вигляді (5.9), то, з урахуванням сталості температури, воно набуде вигляду:
 =
= 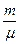 RT або
RT або 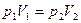 ,
,  при T = const (5.11)
при T = const (5.11)
Рівняння (5.11) до створення молекулярно-кінетичної теорії було здобуто з експериментів англійським фізиком Р. Бойлем (1662 р.) і незалежно французьким фізиком Е. Маріоттом (1676 р.).
Закон Бойля – Маріотта можна сформулювати так: для ідеального газу деякої маси (сталої кількості речовини) за сталої температури тиск газу змінюється обернено пропорційно до об’єму.Цей закон, як і інші газові закони, є результатом із рівняння стану газу і справедливий для будь-яких газів, які можна вважати ідеальними, а також для їх сумішей (наприклад, для повітря). Перевірити цей закон експериментально ви зможете, виконавши лабораторну роботу №4. Для підтримання сталої температури газу потрібно, щоб він міг обмінюватися теплотою з великою системою – термостатом. Термостатом може бути атмосферне повітря, якщо його температура помітно не змінюється протягом процесу. Температура газу буде сталою також, якщо стискати або розширювати газ дуже повільно.
Часто закон Бойля – Маріотта записують так: р =  . Графічно залежність тиску газу сталої маси від об’єму при умові
. Графічно залежність тиску газу сталої маси від об’єму при умові  можна зобразити у вигляді гіперболи (порівняйте з у =
можна зобразити у вигляді гіперболи (порівняйте з у = 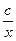 ), яка для цього процесу називається ізотермою (мал. 5.20). Різним температурам відповідають різні ізотерми – чим вища температура, тим вище на координатній площині рV знаходиться гіпербола (Т2 > Т1). Це корисно знати для розв’язування графічних задач.
), яка для цього процесу називається ізотермою (мал. 5.20). Різним температурам відповідають різні ізотерми – чим вища температура, тим вище на координатній площині рV знаходиться гіпербола (Т2 > Т1). Це корисно знати для розв’язування графічних задач.
На координатних площинах рТ і VT ізотерми зображуються прямими, перпендикулярними до осі температур. На мал. 5.21 зображені графіки двох ізотермічних процесів у координатах  ,
, 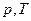 та
та 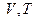 . Ізотермічним можна вважати процес стиснення повітря компресором або розширення під поршнем насоса газу в результаті відкачування його з посудини.
. Ізотермічним можна вважати процес стиснення повітря компресором або розширення під поршнем насоса газу в результаті відкачування його з посудини.
Ізобарний процес. Закон Гей-Люссака.Процес зміни стану термодинамічної системи за сталого тиску називають ізобарним(від грец. барос – вага) (  ,
, 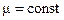 ,
,  ). Щоб здійснити ізобарний процес, необхідно нагріти або охолодити газ, не закріплюючи поршень у циліндрі (див. мал. 5.23). Відповідно до рівняння (5.9) для ідеального газу певної маси з незмінним тиском відношення об’єму до температури залишається сталим:
). Щоб здійснити ізобарний процес, необхідно нагріти або охолодити газ, не закріплюючи поршень у циліндрі (див. мал. 5.23). Відповідно до рівняння (5.9) для ідеального газу певної маси з незмінним тиском відношення об’єму до температури залишається сталим:
 =
= 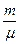
 або
або 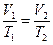 при p = const (5.12)
при p = const (5.12)
Цей закон установив експериментально у 1802 р. французький учений Гей-Люссак. Відповідно до (5.12) об’єм газу лінійно залежить від температури за сталого тиску:
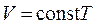 (
( 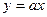 ).
).
Експериментально перевірити цей закон можна за допомогою пристрою, що є в багатьох кабінетах фізики – скляної колби із зігнутою трубкою (мал. 5.24). У горизонтальній частині трубки є крапля рідини, яка відокремлює газ у колбі від атмосферного повітря. Якщо підігріти колбу (можна й руками), то крапля рідини зміститься вправо, тобто об’єм газу, який знаходиться в колбі, збільшиться, а тиск залишиться рівним атмосферному.
Графік залежності об’єму від температури за сталого тиску є прямою лінією, яку називають ізобарою. На мал. 5.25 а зображено дві ізобари в координатах  за різних значень тиску
за різних значень тиску 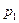 і
і  , причому
, причому 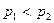 . На мал. 5.25 б, в наведено графіки ізобарного процесу в координатах
. На мал. 5.25 б, в наведено графіки ізобарного процесу в координатах 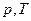 ,
, 
Ізохорний процес. Закон Шарля.Процес зміни стану термодинамічної системи за сталого об’єму називають ізохорним (від грец. хорема – місткість). Якщо  ,
, 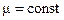 ,
, 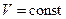 , то з рівняння стану (5.9) випливає, що для ідеального газу певної маси з незмінним об’ємом відношення тиску газу до температури залишається сталим:
, то з рівняння стану (5.9) випливає, що для ідеального газу певної маси з незмінним об’ємом відношення тиску газу до температури залишається сталим:
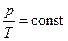 =
= 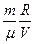 або
або 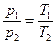 при V = const (5. 13)
при V = const (5. 13)
У 1787 р. цей газовий закон експериментально встановив французький фізик Ж. Шарль, тому його називають законом Шарля. Закон можна також перевірити експериментально за допомогою установки для перевірки газових законів (мал. 5.25).
Відповідно до (5.21) тиск газу лінійно залежить від температури за сталого об’єму:
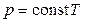 (
( 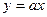 ).
).
Графіком залежності тиску від температури за сталого об’єму є пряма лінія, яку називають ізохорою. На мал. 5.26 а в координатах 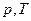 зображено дві ізохори за різних значень об’єму
зображено дві ізохори за різних значень об’єму 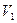 і
і 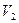 , причому
, причому 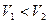 . На мал. 5.26 б, в наведено графіки процесу в координатах
. На мал. 5.26 б, в наведено графіки процесу в координатах 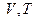 і
і  .
.
Отже, ви переконалися, що газові закони Бойля – Маріотта , Гей-Люссака, і Шарля – це часткові випадки рівняння Клапейрона-Менделєєва.
Газові закони і їх графічні ілюстрації дають змогу вивчати довільні термодинамічні процеси з ідеальним газом. Наприклад, як встановити нагрівається чи охолоджується газ під час переходу зі стану 1 у стан 2 (мал. 5.27). Для того, щоб це визначити, проводять кілька ізотерм. Газ охолоджується, адже ізотерма 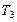 знаходиться нижче ізотерми
знаходиться нижче ізотерми 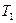 .
.
? Запитання для самоперевірки
1. Що таке ізопроцеси?
2. Який процес називають ізотермічним? Яким законом описується цей процес? Як формулюють і записують цей закон? Зобразіть і поясніть графіки цього закону.
3. Який процес називають ізохорним? Яким законом описують ізохорний процес? Як формулюють і записують цей закон? Зобразіть і поясніть графік цього закону.
4. Який процес називають ізобарним? Яким законом описують ізобарний процес? Як формулюють і записують цей закон? Зобразіть і поясніть графік цього закону.
5. Побудуйте ізотерму, ізохору, ізобару в координатах  ,
, 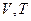 ,
, 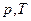 .
.