 |
|
Среднеквадратичная скорость
Подставляя f(  и интегрируя, мы получим:
и интегрируя, мы получим:
<  =
=  =
=  .
.
Т.о., скорости, которые характеризуют состояние газа:
1) наиболее вероятная  =
= 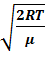 =
=  ,
,
2) средняя <  =
=  = 1,13
= 1,13  ,
,
3)средняя квадратичная  =
=  =1,22
=1,22 
Экспериментальная проверка закона распределения Максвелла -– опыт Штерна
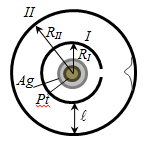 Вдоль оси внутреннего цилиндра с целью натянута платиновая проволока, покрытая слоем серебра, которая нагревается током. При нагревании серебро испаряется, атомы серебра вылетают через щель и попадают на внутреннюю поверхность второго цилиндра. Если оба цилиндра неподвижны, то все атомы независимо от их скорости попадают в одно и то же место В (рис. 113).
Вдоль оси внутреннего цилиндра с целью натянута платиновая проволока, покрытая слоем серебра, которая нагревается током. При нагревании серебро испаряется, атомы серебра вылетают через щель и попадают на внутреннюю поверхность второго цилиндра. Если оба цилиндра неподвижны, то все атомы независимо от их скорости попадают в одно и то же место В (рис. 113).
Рис.113.
При вращении цилиндров с угловой скоростью ω атома серебра попадут в точки В’, B’’ и так далее. По величине ω, расстоянию l и смещению х = ВВ’ можно вычислить скорость атомов, попавших в точку В’.
x =  RII;
RII;  =
= 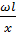 RII.
RII.
Изображение щели получается размытым. Исследуя толщину осаждённого слоя, можно оценить распределение молекул по скоростям, которое соответствует максвелловскому распределению.
1.11. Основное уравнение молекулярно – кинетической теории (уравнение Клаузиуса[28])
Рассмотрим идеальный газ в равновесном состоянии, вне силовых полей внутри куба с ребром l. Давление газа на грани куба обусловлен6о ударами молекул.
Упрощённое доказательство уравнения
Молекулы движутся беспорядочно, поэтому все направления их движения равновероятны:  N молекул из их общего числа N будет двигаться между каждыми двумя гранями куба.
N молекул из их общего числа N будет двигаться между каждыми двумя гранями куба.
Обозначим: mi –масса молекулы,  -–скорость молекулы, ∆t – время удара молекулы о стенку, k – количество ударов i - той молекулы о стенку за некоторое время t;
-–скорость молекулы, ∆t – время удара молекулы о стенку, k – количество ударов i - той молекулы о стенку за некоторое время t;  - время между двумя последовательными соударениями молекулы со стенкой.
- время между двумя последовательными соударениями молекулы со стенкой.
Считаем молекулы классическими частицами, удары молекул о стенку упругими. По второму закону Ньютона сила удара i – той молекулы о стенку (рис. 114): fi =  . (1)
. (1)

Рис. 114.
За время t молекула ударит о стенку k раз и передаст ей импульс (2mi  k).
k).
Средняя сила, действующая на стенку со стороны i - той молекулы:
<Fi > = k  , (2)
, (2)
где k =  =
= 
 , т.к.
, т.к.  =
=  .
.
Получаем: <Fi > = 
 .
.
Средняя (за время t) сила давления i – той молекулы на стенку:
<Fi> =  . (3)
. (3)
Т.к. разные молекулы движутся с различными скоростями, то давление со стороны всей совокупности молекул, движущихся между двумя противоположными стенками:
<F> =  +
+  + … +
+ … +  . (4)
. (4)
Т.к. n =  N – число молекул, движущихся между двумя противоположными гранями куба, то (4) примет вид:
N – число молекул, движущихся между двумя противоположными гранями куба, то (4) примет вид:
<F> =  = =
= = 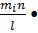
 ,
,
или <F> = 
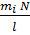
 |:
|:  (5)
(5)
Получим:  =
= 
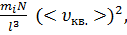 (6)
(6)
где l2 – площадь грани куба, l3 - объём куба.
Тогда (6) примет вид: P =  n0 mi
n0 mi  P =
P =  n0
n0  , (7)
, (7)
где <Eк> =  – средняя кинетическая энергия поступательного движения молекул.
– средняя кинетическая энергия поступательного движения молекул.
Тогда уравнение (7) примет вид:
P =  n0 <Eк>. (8)
n0 <Eк>. (8)
Уравнение (8) – основное уравнение МКТ (уравнение Клаузиуса):
давление идеального газа прямо пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
Учтём, что  . (9)
. (9)
Подставив (9) в (7), получим: P=  n0
n0  = n0kT,
= n0kT,
т.е. в итоге получаем: P= n0 k T. (10)
Уравнение (10) – уравнение состояния идеального газа:
давление идеального газа пропорционально концентрации молекул газа и его абсолютной температуры.
Из уравнений (9) и (8) следует:  n0 <Eк> = n0 k T => <Eк> =
n0 <Eк> = n0 k T => <Eк> =  k T,
k T,
т.е. абсолютная температура является мерой средней кинетической энергии теплового поступательного движения молекул.
1.12. Уравнение Менделеева[29] - Клапейрона[30]
Уравнение Менделеева – Клапейрона -–уравнение состояния идеального газа, устанавливающее связь между его объемом V, давлением P и абсолютной температурой T.
Рассматриваем идеальный газ. Уравнение состояния идеального газа:
P = n0 k T |  V,
V,
где V – объём газа.
Получаем: PV = n0V kT. Учтём, что N = n0V =  Na – число частиц газа, где
Na – число частиц газа, где  -–число молей газа, Na – постоянная Авогадро.
-–число молей газа, Na – постоянная Авогадро.
Тогда получаем: PV = NkT =  Na kT, где Na k = R = 8,31
Na kT, где Na k = R = 8,31  – универсальная газовая постоянная.
– универсальная газовая постоянная.
Окончательно получаем: PV=  RT.
RT.
Последнее уравнение является уравнением состояния идеального газа и называется уравнением Менделеева – Клапейрона.
Частные случаи уравнения Менделеева – Клапейрона
Рассматриваем идеальный газ постоянной массы (m = const):
Изотермический процесс – процесс, протекающий в системе постоянной массы при постоянной температуре (T=const).
Процесс описывается законом Бойля[31]- Мариотта[32]: произведение объёма данной массы газа на его давление постоянно при постоянной температуре: PV=const.
Изобарный процесс – процесс, протекающий в системе постоянной массы при постоянном давлении (P=const).
Процесс описывается законом Гей – Люссака[33]: отношение объёма данной массы газа его абсолютной температуре при постоянном давлении есть величина постоянная:

Изохорный процесс – процесс, протекающий в системе постоянной массы при постоянном объёме (V = const).
Процесс описывается законом Шарля[34] : отношение давление данной массы газа при постоянном объемё его абсолютной температуре есть величина постоянная:

Закон Дальтона[35]
В состоянии теплового равновесия давление в смеси идеальных газов равно сумме давлений каждой компоненты смеси:
P = P1 + P2 + … +Pn = 