 |
|
Изоморфизм и полиморфизм кристаллов
Многие кристаллические вещества имеют одинаковые структуры. В то же время одно и то же вещество может образовывать разные кристаллические структуры. Это находит отражение в явлениях изоморфизма и полиморфизма.
Изоморфизм(от греческих «изос» – равный и «морфе» – форма) заключается в способности атомов, ионов или молекул замещать друг друга в кристаллических структурах.
Закон изоморфизма гласит: «Одинаковые количества атомов, соединенные одинаковым способом, дают одинаковые кристаллические формы; при этом кристаллическая форма не зависит от химической природы атомов, а определяется только их числом и относительным положением».
При совместной кристаллизации веществ, склонных к изоморфизму (изоморфных веществ), образуются смешанные кристаллы (изоморфные смеси). Это возможно лишь в том случае, если замещающие друг друга частицы мало различаются по размерам (не более 15%). Кроме того, изоморфные вещества должны иметь сходное пространственное расположение атомов или ионов и, значит, сходные по внешней форме кристаллы. К таким веществам относятся, например, квасцы.
Изоморфизм широко распространен в природе. Большинство минералов представляет собой изоморфные смеси сложного переменного состава. Например, в минерале сфалерите ZnS до 20% атомов цинка могут быть замещены атомами железа (при этом ZnS и FeS имеют разные кристаллические структуры). С изоморфизмом связано геохимическое поведение редких и рассеянных элементов, их распространение в горных породах и рудах, где они содержатся в виде изоморфных примесей.
Изоморфное замещение определяет многие полезные свойства искусственных материалов современной техники – полупроводников, ферромагнетиков, лазерных материалов.
Многие вещества могут образовывать кристаллические формы, имеющие различные структуру и свойства, но одинаковый состав (полиморфные модификации).
Полиморфизм (от греч. полиморфос» – многообразный) – способность твердых веществ и жидких кристаллов существовать в двух или нескольких формах с различной кристаллической структурой и свойствами при одном и том же химическом составе.
Полиморфизм простых веществ обычно называют аллотропией, в то же время понятие полиморфизма не относится к некристаллическим аллотропным формам (например, газообразным О2 и О3). Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам — так называемых аллотропных (или аллотропических) модификаций или форм.
Типичный пример полиморфных форм – модификации углерода (алмаз, лонсдейлит, графит, карбины и фуллерены), которые резко различаются по свойствам (рис. 159).

Рис. 159.Аллотропные модификации углерода: кристаллические решётки алмаза (а) и графита (б).
Наиболее стабильной формой существования углерода является графит, однако и другие его модификации при обычных условиях могут сохраняться сколь угодно долго. При высоких температурах они переходят в графит. В случае алмаза это происходит при нагревании выше 1000 oС в отсутствие кислорода. Обратный переход осуществить гораздо труднее. Необходима не только высокая температура (1200-1600 oС), но и гигантское давление – до 100 тысяч атмосфер. Превращение графита в алмаз проходит легче в присутствии расплавленных металлов (железа, кобальта, хрома и других).
В случае молекулярных кристаллов полиморфизм проявляется в различной упаковке молекул в кристалле или в изменении формы молекул, а в ионных кристаллах – в различном взаимном расположении катионов и анионов. Некоторые простые и сложные вещества имеют более двух полиморфных модификаций. Например, диоксид кремния имеет десять модификаций, фторид кальция – шесть, нитрат аммония – четыре. Полиморфные модификации принято обозначать греческими буквами α, β, γ, δ, ε,… начиная с модификаций, устойчивых при низких температурах.
Переход одной полиморфной модификации в другую называется полиморфными превращениями. Эти переходы происходят при изменении температуры или давления и сопровождаются скачкообразным изменением свойств. Полиморфные превращения могут проходить и без существенного изменения структуры. Иногда изменение кристаллической структуры вообще отсутствует, например, при переходе α-Fe в β-Fe при 769 oС структура железа не меняется, однако исчезают его ферромагнитные свойства.
Понятие об оптической оси кристалла
Оптическая ось кристалла - направление в кристалле, вдоль которого скорость света не зависит от ориентации плоскости поляризации света. Свет, распространяющийся вдоль оптической оси кристалла, не испытывает двойного лучепреломления.
В одноосных кристаллах таких направлений — одно, а в двуосных — два. Так если свет будет распространяться вдоль оптической оси одноосного кристалла (например, кальцит, кварц), то ничего необычного не произойдёт. Однако если луч света будет не параллелен оптической оси, то, при прохождении через кристалл он расщепится на два: обыкновенный и необыкновенный, которые будут взаимно перпендикулярно поляризованы.
Показатель преломления обыкновенного луча постоянен для любого направления в кристалле, а необыкновенного луча переменный и зависит от направления. В одноосном кристалле для направления, параллельного оптической оси, их показатели преломления равны.
Типы кристаллических решёток
Твердые кристаллы – трехмерные образования, характеризующиеся строгой повторяемостью одного и того же элемента структуры (элементарной ячейки) во всех направлениях. Элементарная ячейка представляет собой наименьший объем кристалла в виде параллелепипеда, повторяющегося в кристалле бесконечное число раз.
Кристалл с определенной химической формулой имеет присущую ему кристаллическую структуру.
Кристаллические структуры – это структуры, представляющие периодическую решетку, в узлах которой расположены атомы.
Классификация кристаллических форм основана на симметрии кристаллов.
Трехмерная кристаллическая структура представляет решетку, построенную на трех координатных осях x, y, z, расположенных в общем случае под углами  ,
, 
 , . Элементарная ячейка кристалла – это параллелепипед, построенный на векторах трансляции a, b, c. Такая ячейка называется примитивной[56] (рис. 160). Длины ребер а, b и с кристаллической ячейки называются периодами идентичности кристалла. Различные кристаллографические систем отличаются друг от друга формой элементарной ячейки: соотношениями между длинами ребер a, b и c и углами α, β и γ между гранями. Весь кристалл может быть получен путем многократного повторения в трех различных направлениях примитивной кристаллической ячейки.
, . Элементарная ячейка кристалла – это параллелепипед, построенный на векторах трансляции a, b, c. Такая ячейка называется примитивной[56] (рис. 160). Длины ребер а, b и с кристаллической ячейки называются периодами идентичности кристалла. Различные кристаллографические систем отличаются друг от друга формой элементарной ячейки: соотношениями между длинами ребер a, b и c и углами α, β и γ между гранями. Весь кристалл может быть получен путем многократного повторения в трех различных направлениях примитивной кристаллической ячейки.

Рис. 160.
В результате трансляции примитивной ячейки в пространстве получается пространственная простая решетка – так называемая решетка Браве[57]. Существует четырнадцать типов решеток Браве. Эти решетки отличаются друг от друга видом элементарных ячеек.
Решётки Браве – 14 трёхмерных геометрических решёток, характеризующих все возможные типы трансляции оной симметрии кристаллов.
Решетки Браве подразделяются на семь систем, называемых кристаллографическими сингониями, в соответствии с семью различными типами элементарных ячеек: триклинной, моноклинной, ромбической, тетрагональной, тригональной, кубической и гексагональной (рис. 161).
Сингонии:
- Низшая категория (все трансляции не равны друг другу)
- Триклинная: a

 .
. - Моноклинная: a
 .
. - Ромбическая: a

 =
=  =
= 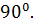 ,
,
- Средняя категория (две трансляции из трёх равны между собой)
- Тетрагональная: a = b
 c;
c;  =
=  =
= 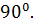
- Гексагональная: a = b
 c;
c;  =
=  = 1200.
= 1200.
- Высшая категория (все трансляции равны между собой)
Кубическая: a = b = c;  900.
900.
Все возможные сочетания имеющихся в кристаллической решётке поворотных осей симметрии и зеркальных плоскостей симметрии приводят к делению кристаллов на 32 класса симметрии, а с учётом винтовых осей симметрии и скользящих плоскостей симметрии на 230 пространственных групп.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом. Так в решетке хлорида натрия координационные числа ионов натрия и хлора равны 6.
Типы решёток Браве
| Сингония | Параметры элементарной ячейки | Тип элементарной ячейки | Изображение |
| Кубическая | a = b = c α = β = γ = 90° | Примитивная | 
|
| Объемоцентрированная | 
| ||
| Гранецентрированная | 
| ||
| Тетрагональная | a = b  c α = β = γ = 90° c α = β = γ = 90°
| Примитивная | 
|
| Объемоцентрированная | 
| ||
| Гексагональная | a = b  c α = β = 90°
γ = 120° c α = β = 90°
γ = 120°
| Примитивная | 
|
| Тригональная (ромбоэдрическая) | a = b = c α = β = γ  90° 90°
| Примитивная | 
|
| Ромбическая | a  b b  c α = β = γ = 90° c α = β = γ = 90°
| Примитивная | 
|
| Объемоцентрированная | 
| ||
| Базоцентрированная | 
| ||
| Гранецентрированная | 
| ||
| Моноклинная | a  b b  c α = β = 90°
γ c α = β = 90°
γ  90° 90°
| Примитивная | 
|
| Базоцентрированная | 
| ||
| Триклинная | a  b b  c c     γ γ  90° 90°
| Примитивная | 
|
Рис. 161.
Эти элементарные ячейки могут быть как примитивными, так и сложными (рис. 162): объёмоцентрированными гранецентрированными, базоцентрированными, гексагональными.


а). объемноцентрированная б). гранецентрированная
в). базоцентрированная г). гексагональная
Рис. 162.
Объемноцентрированная (ОЦ) ячейка (рис.162 а) – содержит дополнительно один атом на пересечении пространственных диагоналей куба (или, в общем случае, параллелепипеда). В ОЦ кубической структуре (ОЦК) кристаллизуются такие металлы, как 23V, 24Cr, 26Fe, 41Nb, 73Ta, 74W (индекс слева внизу обозначает номер элемента в периодической системе элементов Д. И. Менделеева).
Гранецентрированная (ГЦ) ячейка (рис.162 б) – содержит дополнительно по одному атому в плоскости каждой грани. В ГЦ кубической структуре (ГЦК) кристаллизуются металлы 13Al, 28Ni, 29Cu, 47Ag, 78Pt, 79Au и др.
Базоцентрированная (БЦ) ячейка (рис.162 в) – содержит дополнительно по одному атому в центрах противоположных граней.
Гексагональная ячейка (рис. 162 г) состоит из трех примитивных ячеек, и, как и БЦ ячейка, содержит по одному атому в центре противоположных граней. В гексагональной структуре кристаллизуются многие металлы – 22Ti, 27Co, 30Zn, 39Y, 40Zr, 64Gd, 71Lu.
Объём элементарной ячейки в общем случае вычисляется по формуле:
V = abc  .
.
Типы кристаллических решёток
В зависимости от типа частиц, расположенных в узлах кристаллической решётки, и характера связи между ними различают 4 типа кристаллических решёток: ионные, атомные, молекулярные, металлические. Рассмотрим каждую из решёток в отдельности.
1). Ионные кристаллы
Ионными называют кристаллические решетки, в узлах которых находятся ионы разных знаков.
Силы взаимодействия между ними являются в основном электростатическими (кулоновскими). Связь называется ионной (гетерополярной). Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов (NaCl; CaCO3 и др.).
Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия (рис. 163).
 Рис. 163.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов. Весь кристалл можно считать огромной молекулой. Размеры такой молекулы не ограничены, поскольку она может расти, присоединяя новые катионы и анионы.
Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи. Расплавы их хорошо проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
2). Атомные кристаллы
Атомными (валентными) называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными (гомеополярными) связями (C; Ge; Te и др.).
В узлах кристаллической решётки помещаются нейтральные атомы. Силы взаимодействия при гомеополярной связи имеют также электрический (но не кулоновский характер). Объяснение природы этих сил даётся в квантовой механике.
Примером может служить алмаз – одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4 (рис. 163).
Так же как и ионные, атомные кристаллы можно считать гигантскими молекулами. В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз – самый твёрдый природный материал.
Рис. 163.
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов. Весь кристалл можно считать огромной молекулой. Размеры такой молекулы не ограничены, поскольку она может расти, присоединяя новые катионы и анионы.
Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи. Расплавы их хорошо проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
2). Атомные кристаллы
Атомными (валентными) называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными (гомеополярными) связями (C; Ge; Te и др.).
В узлах кристаллической решётки помещаются нейтральные атомы. Силы взаимодействия при гомеополярной связи имеют также электрический (но не кулоновский характер). Объяснение природы этих сил даётся в квантовой механике.
Примером может служить алмаз – одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4 (рис. 163).
Так же как и ионные, атомные кристаллы можно считать гигантскими молекулами. В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз – самый твёрдый природный материал.
6). Металлические кристаллы |
Металлическими называют решётки, в узлах которых находятся атомы и ионы металла (Na; Cu; Al и др.).
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно движутся электроны, отщепившиеся от атомов при образовании ионов. «Электронный газ» «стягивает» положительные ионы, уравновешивает отталкивание между ионами (рис. 165).

Рис. 165.
Связь в таких кристаллах является делокализованной и распространяется на весь кристалл. Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легко деформируются.
Дефекты в кристаллах
Идеальный кристалл – идеализированная модель кристалла бесконечных размеров, со строго периодическим расположением атомов. Реальные кристаллы существенно отличаются от идеальной пространственной решётки, неизбежно содержат различные дефекты и ограничены поверхностью. Наличие кристаллических дефектов следует из множества фактов, в т.ч. из непосредственных электронно-микроскопических наблюдений. Однако основные представления о дефектности кристалла внутри объёма возникли, прежде всего, из измерений прочности: кристалл разрушается при напряжениях в сотни раз меньших тех, которые мы ожидали бы для идеального объекта.
Дефект кристаллической решетки – отклонение кристаллической решетки от ее идеального периодического строения. Дефекты оказывают существенное влияние на физические свойства кристаллов.
Чтобы классифицировать дефекты кристаллической решетки, необходимо ввести некоторое понятие совершенного кристалла, относительно которого можно определять характерные признаки несовершенства кристаллической решетки.
Совершенным кристаллом называется полностью симметричная бесконечная структура с атомами, размещенными строго в узлах решетки, причем кристалл в целом находится в своем основном квантово-механическом состоянии (при Т=0 К, когда квантово-механическая система имеет наименьший энергетический уровень). При любых нарушениях в расположении атомов или возбуждениях основного состояния говорят о несовершенном кристалле. Характером и степенью нарушения правильности, или совершенства, кристаллического строения в значительной мере определяются свойства кристаллических тел.
Различают дефекты по Шотки (незанятые узлы решетки) и дефекты по Френкелю (смещение местоположения ионов). Две вакансии противоположного знака образуют дефект по Шотки. Пара, состоящая из межузельного иона и оставленной им вакансии, называется дефектом по Френкелю.
Дефекты кристаллического строения удобно классифицировать по их геометрической форме и размерам:
1) точечные (нульмерные) малы во всех трех измерениях, их размеры не больше нескольких атомных диаметров – это вакансии, межузельные атомы, примесные атомы;
2) линейные (одномерные) малы в двух направлениях, а в третьем направлении они соизмеримы с длиной кристалла – это дислокации, цепочки вакансий и межузельных атомов;
3) поверхностные (двумерные) малы только в одном направлении и имеют плоскую форму – это границы зерен, блоков и двойников, границы доменов;
4) объемные (трехмерные) имеют во всех трех измерениях относительно большие размеры – это поры, трещины.
5). Блочная структура кристалла.
1). Блочная структура
Монокристалл не представляет собой единой решётки, а состоит из огромного числа мельчайших блоков, слегка (в пределах секунд или минут дуги) дезориентированных друг по отношению к другу. Размеры блоков лежат в пределах 10-8  10-6 м (рис. 157).
10-6 м (рис. 157).
2). Точечные дефекты внутри блока
Внутри блоков могут быть точечные дефекты в виде пустых мест, а так же в виде примесей чужеродных атомов. Эти дефекты нарушают дальний порядок.
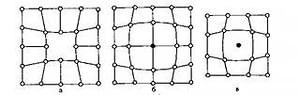
а б в
Рис. 166.
Незанятый узел решётки называется вакансией (рис. 166 а), а атомы, расположенные между узлами, называются внедрёнными (рис. 166 б, в).
Вакансии находятся в термодинамическом равновесии с кристаллической решеткой, они возникают и исчезают в результате теплового движения атомов.
Число вакансий при нормальной (комнатной) температуре мало по сравнению с общим числом атомов (для металлов примерно 1 вакансия на 1018 атомов), но сильно увеличивается с повышением температуры.
Помимо этого есть ещё специфические дефекты полупроводников.
Акцептор – дефект кристаллической решетки полупроводника, в виде примесного атома, который может захватывать электроны из валентной зоны у доноров, образуя при этом дырки, участвующие в электропроводности. Донор – дефект кристаллической решетки полупроводника, способный отдавать электроны в зону проводимости.
Доноры в полупроводниковом кристалле могут быть обусловлены примесью или дислокациями.
Наличие подобных дефектов, даже в незначительных количествах, сильно влияет на свойства кристалла. Так, примеси в кристаллической решётке германия или кремния, составляющие 0,1%, практически не влияет на структуру кристалла, но очень существенно – в тысячи раз меняют его электрическое соединение.
3). Линейные дефекты - дислокации
Кроме точечных, существуют дефекты, сосредоточенные вблизи некоторых линий – линейные дефекты дислокации.
Дислокация (от лат. dislocatio – смещение, перемещение) в кристаллах – линейный дефект кристаллической решетки, представляющий собой нарушение правильного чередования атомных плоскостей.
Простейшими из них являются простая (краевая) и винтовая дислокации. Дислокации смешанного типа являются комбинацией указанных двух типов.
Простая (узловая) дислокация заключается в том, что в каком-либо участке кристалла образуется лишняя узловая плоскость (рис. 167). В результате кристалл оказывается разбитым на два блока, на линии раздела которых и лежит ядро дислокации, обозначаемое знаком «  ».
».

Рис. 167.
Линия, отделяющая дефектную область кристалла от бездефектной, называется линией дислокации (рис. 168). Простейшая наглядная модель краевой дислокации — книга, у которой от одной из внутренних страниц оторвана часть. Тогда, если страницы книги уподобить атомным плоскостям, то край оторванной части страницы моделирует линию дислокации.

Рис. 168.
Винтовая дислокация образуется в том случае, если линия узлов одного из блоков некоторой своей частью как бы соскользнёт на один период выше или ниже своего нормального направления (рис. 169).

Рис. 169.
Наибольшее искажение здесь возникает вдоль оси дислокации.
Влияние дефектов на механические свойства кристаллов
Дислокации очень сильно влияют на механические свойства кристаллов. В частности, дислокации служат причиной того, что пластическая деформация реальных кристаллов происходит под воздействием напряжений на несколько порядков меньше, чем вычисленное для идеальных кристаллов. Так, например, сдвиг у монокристаллов объясняется не смещением всего атомного слоя одновременно как целого (рис. 170), а движением дислокаций (рис. 171).

Рис. 170.

Рис. 171.
Перемещению дислокаций препятствует наличие других дефектов, в т.ч. точечных. Дислокации тормозятся и при пересечении друг с другом. Если количество дефектов в кристалле мало, то дислокации перемещаются практически свободно, т.е. сопротивление сдвигу будет невелико. Увеличение плотности дислокаций и возрастание концентрации примесей приводит к сильному торможению дислокаций. В результате прочность материала возрастает. Так, повышение прочности железа достигается растворением в нём атомов углерода (сталь).
Пластическая деформация сопровождается разрушением кристаллической решётки и образованием больших количеств дефектов, препятствующих перемещению дислокаций. Этим объясняется упрочнение материалов при их холодной обработке (ковка, прокат).
Прочность кристаллов резко понижается за счёт трещин, возникающих на его поверхности в местах выхода дислокаций.
Теплоёмкость кристаллов
Для твёрдых тел не различают теплоёмкости СР и СV.
Основной вклад в теплоёмкость неметаллических твёрдых тел вносит энергия тепловых колебаний частиц, находящихся в узлах кристаллических решёток. Для металлов незначительный вклад в теплоёмкость вносит вырожденный электронный газ.
В основе классической теории теплоёмкостей лежит закон равномерного распределения энергии по степеням свободы. Однородное твёрдое тело рассматривается как система независимых друг от друга частиц, имеющих три степени свободы и совершающих тепловые колебания с одинаковой частотой. Средняя энергия, приходящаяся на одну степень свободы: < E > = kT. Внутренняя энергия моля твёрдого тела:  = 3Na < E > = 3Na kT = 3RT, где Na – постоянная Авогадро, k – постоянная Больцмана, R – универсальная газовая постоянная.
= 3Na < E > = 3Na kT = 3RT, где Na – постоянная Авогадро, k – постоянная Больцмана, R – универсальная газовая постоянная.
Молярная теплоёмкость твёрдого тела с атомной кристаллической решёткой:
 =
=  = 3R = 25, 12
= 3R = 25, 12  .
.
Правило Дюлонга[58] и Пти[59]: молярная теплоёмкость всех химически простых кристаллических твёрдых тел при постоянном объёме не зависит от температуры и равна 25, 12  .
.
Таким образом, молярная теплоёмкость  не зависит ни от температуры Т, ни от других характеристик кристалла. Опыт опровергает это, особенно в области низких температур. Зависимость молярной теплоёмкости
не зависит ни от температуры Т, ни от других характеристик кристалла. Опыт опровергает это, особенно в области низких температур. Зависимость молярной теплоёмкости  от температуры имеет характер, показанный на рис. 172.
от температуры имеет характер, показанный на рис. 172.
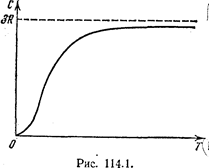
Рис. 172.
Эти и другие экспериментальные факты получили своё объяснение в квантовой теории теплоёмкостей.
 Рис. 163.
3). Молекулярные кристаллы
Молекулярными называют кристаллические решетки, в узлах которых располагаются определённым образом ориентированные молекулы.
Число неорганических веществ с молекулярной решеткой невелико. Примерами их являются лед, твердый оксид углерода (IV) («сухой лед»), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Сl2, Br2, I2, Н2, О2, N2), трех- (О3), четырех- (Р4), восьми- (S8) атомными молекулами. Большинство кристаллических органических соединений имеют молекулярную решетку. Молекулярная кристаллическая решетка йода показана на рис. 164.
Химические связи в них ковалентные, как полярные так и не полярные. Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Эти силы имеют ту же природу, что и силы притяжения между молекулами, приводящие к отклонению газов от идеальности. Эти силы называются ванн – дер – ваальсовскими силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток.
Рис. 163.
3). Молекулярные кристаллы
Молекулярными называют кристаллические решетки, в узлах которых располагаются определённым образом ориентированные молекулы.
Число неорганических веществ с молекулярной решеткой невелико. Примерами их являются лед, твердый оксид углерода (IV) («сухой лед»), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Сl2, Br2, I2, Н2, О2, N2), трех- (О3), четырех- (Р4), восьми- (S8) атомными молекулами. Большинство кристаллических органических соединений имеют молекулярную решетку. Молекулярная кристаллическая решетка йода показана на рис. 164.
Химические связи в них ковалентные, как полярные так и не полярные. Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Эти силы имеют ту же природу, что и силы притяжения между молекулами, приводящие к отклонению газов от идеальности. Эти силы называются ванн – дер – ваальсовскими силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток.
 Рис. 164.
Рис. 164.