 |
|
Рівняння масоперенесення
Ханик Я.М. та ін.
|
І.О. Гузьова, Т.І. Римар, Л.З. Білецька; За ред. Я.М. Ханика. Ч. IV. – Серія “Дистанційне навчання”. – № 48. – Львів: Видавництво Національного університету “Львівська політехніка”, 2009. – 300 с.
У навчальному посібнику розкрито основні закономірності масоперенесення в аспекті рідина–рідина, рідина–газ, тверде тіло–газ, рідина. Одночасно наведені контрольні питання, задачі і приклади їх розв’язання. Посібник складається з трьох розділів.
Навчальний посібник призначений для студентів стаціонарної і дистанційної форм навчання.
© Ханик Я.М., Гузьова І.О.,
Римар Т.І., Білецька Л.З., 2009
ЗМІСТ
Розділ І. Основи масоперенесення............................................................ 5
1.1. Загальні відомості ......................................................................... 5
1.2. Рівновага під час масоперенесення .............................................. 8
1.3. Швидкість масоперенесення ...................................................... 13
1.4. Рушійна сила процесів масоперенесення .................................. 31
1.5. Розрахунок основних розмірів масообмінних апаратів ............ 38
1.6. Масоперенесення з твердою фазою ........................................... 48
Питання до розділу І ................................................................................... 53
Основні залежності і розрахункові формули до розділу І ........................ 55
Контрольні задачі ........................................................................................ 67
Розділ ІІ. Абсорбція................................................................................... 70
2.1. Загальні відомості........................................................................ 70
2.2. Рівновага під час абсорбції ......................................................... 70
2.3. Матеріальний баланс та витрата абсорбенту ............................ 75
2.4. Тепловий баланс ......................................................................... 77
2.5. Швидкість фізичної абсорбції .................................................... 78
2.6. Будова абсорбційних апаратів ................................................... 80
2.6.1. Поверхневі та плівкові абсорбери .................................... 81
2.6.2. Насадкові абсорбери ......................................................... 84
2.6.3. Барботажні (тарілчасті) абсорбери .................................. 90
2.6.4. Розпилювальні абсорбери ............................................... 101
2.7. Розрахунок абсорберів ............................................................. 103
2.8. Десорбція ................................................................................... 116
Питання до розділу II ................................................................................ 120
Основні залежності і розрахункові формули до розділу ІІ ..................... 121
Приклади .................................................................................................... 130
Контрольні задачі ...................................................................................... 142
| |
3.1. Загальні відомості ..................................................................... 145
3.2. Характеристики двофазних систем “рідина–пара” ................. 147
3.3. Проста перегонка ...................................................................... 158
3.4. Ректифікація .............................................................................. 164
3.4.1. Схеми установок ректифікацій для розділення
бінарних сумішей ............................................................ 165
3.4.2. Матеріальний і тепловий баланси безперервної
ректифікації бінарних сумішей ....................................... 169
3.4.2.1. Основні положення ............................................. 169
3.4.2.2. Матеріальний баланс ректифікаційної колони .. 170
3.4.2.3. Мінімальне і дійсне флегмове число ................. 174
3.4.2.4. Тепловий баланс ректифікаційної колони ......... 178
3.4.2.5. Ректифікація багатокомпонентних сумішей ..... 184
3.5. Розрахунок ректифікаційних апаратів ..................................... 189
3.5.1. Безперервна ректифікація бінарних сумішей
у насадкових колонах ...................................................... 189
3.5.2. Безперервна ректифікація бінарних сумішей
у тарілчастих колонах ..................................................... 190
3.5.3. Періодична ректифікація бінарних сумішей .................. 192
3.5.4. Ректифікація багатокомпонентних сумішей .................. 193
3.6. Спеціальні види перегонки ....................................................... 195
3.6.1. Екстрактивна ректифікація ............................................. 196
3.6.2. Азеотропна ректифікація ................................................ 198
3.6.3. Молекулярна дистиляція ................................................ 201
3.6.4. Низькотемпературна ректифікація ................................. 204
Питання до розділу IІI ............................................................................... 208
Основні залежності і розрахункові формули до розділу ІІІ .................... 209
Приклади .................................................................................................... 218
Контрольні задачі ...................................................................................... 245
Приклад проектування ректифікаційних установок ................................ 249
Додатки ...................................................................................................... 287
Список літератури ..................................................................................... 299
РОЗДІЛ І
ОСНОВИ МАСОПЕРЕНЕСЕННЯ
1.1. Загальні відомості
Процеси масоперенесення характеризують перехід одного або декількох компонентів із однієї фази в іншу. Вони найчастіше використовуються для розділення гомогенних систем.
Види процесів масоперенесення. У промисловості застосовують процеси масоперенесення за різними комбінаціями твердої, рідкої і газоподібної фаз:
1. Абсорбція – процес поглинання рідкою фазою одного або декількох компонентів із газової фази. Зворотний процес виділення газу із рідини – десорбція.
2. Екстракція (в системі “рідина – рідина”) – селективне поглинання речовини, розчинної в рідині іншою рідиною, яка практично не змішується або частково змішується з першою. При цьому цільовий компонент переходить із однієї рідкої фази в іншу.
3. Ректифікація – розділення гомогенних рідинних сумішей шляхом багаторазового взаємного обміну компонентами між рідкою і паровою фазами, що рухаються переважно протитоком.
4. Адсорбція – поглинання компоненту газу, пари або розчину твердим поглиначем. Процес характеризується переходом речовини із газу чи розчину в тверду фазу. Зворотний процес – десорбція – використовується для регенерації речовини, що поглинулася. Різновидністю адсорбції є іонний обмін – процес розділення, оснований на здатності деяких твердих матеріалів обмінювати свої рухомі іони на іони розчину.
5. Сушіння – процес виділення вологи із твердих матеріалів, переважно, її випаровуванням. При цьому волога переходить із твердої фази в газову.
6. Кристалізація – виділення твердої фази у вигляді кристалів із розчинів або розплавів. Кристалізація характеризується переходом речовини із рідкої фази в тверду внаслідок зміни її розчинності.
7. Розчинення і екстракція (в системі “тверде тіло – рідина”). Розчинення характеризується переходом твердої фази в рідку і являє собою процес, обернений до кристалізації. Селективне розчинення того чи іншого компонента із твердого пористого матеріалу називається екстракцією із твердого тіла, або вилуговуванням.
Масоперенесення, подібно до теплоперенесення, являє собою складний процес, який передбачає перенесення маси речовини в межах однієї фази, перенесення через поверхню розділу фаз та її перенесення в межах іншої фази. Масоперенесення, на відміну від теплоперенесення, передбачає перехід маси із однієї фази в іншу не через стінку, а через поверхню розділу фаз, які контактують між собою.
Перенесення речовини із фази до границі розділу фаз або в зворотному напрямку називається масовіддачею. Розрізняють процеси масоперенесення, в яких беруть участь мінімально три речовини і третя речовина розподіляється між двома першими фазами.
Перші дві фази речовини – це лише фази-носії, між якими розподілено третю речовину.
До другої групи належать процеси масоперенесення (ректифікація), в яких речовини, що складають дві фази, обмінюються між собою компонентами, самі безпосередньо беруть участь у процесі масоперенесення і не можуть розглядатися як інертні носії.
Розподілена речовина в середині кожної фази переноситься шляхом дифузій, тому процеси масоперенесення називають також дифузійними.
Для дифузійних процесів приймають, що кількість речовини, яка переноситься, є пропорційною поверхні розділу фаз і рушійній силі.
Рушійна сила характеризується мірою відхилення системи від стану динамічної рівноваги, яка характеризується різницею хімічних потенціалів розподіленої речовини.
Речовина, що дифундує на границі фази, переміщається із точки з більшою концентрацією до точки з меншою концентрацією, тому в розрахунках рушійну силу процесу масоперенесення подають через різницю концентрацій.
Розрахункові залежності для процесів масовіддачі і масоперенесення неоднакові:
– процеси масоперенесення з твердою фазою відрізняються специфічними особливостями перенесення розподілюваного компонента в середині твердої фази. Тому такі процеси розглядатимуться окремо.
– процеси масоперенесення переважно оборотні і можуть проходити в обох напрямках залежно від температури, тиску та інших умов їх проведення.
Методи вираження складу фаз.Зазвичай кількісний склад фаз подають через:
1. Об’ємну концентрацію – кількість кілограмів або молей, що припадає на одиницю об’єму фази (кг/м3; кмоль/м3).
2. Вагові або мольні частки – відношення кількості кілограмів або кіломолей цього компонента до маси всієї фази, поданої загальною кількістю кілограмів або кіломолей.
3. Відносні концентрації – відношення кількості кілограмів певного компонента, що є розподілювальною речовиною до кількості кілограмів компонента-носія, кількість якого є величиною постійною в процесі масоперенесення. (кг/кг; кмоль/кмоль).
Вагові і мольні частки. Суміш складається з компонентів А, В, … , K, N, вагові частки яких 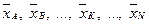 і молекулярні маси відповідно МА, МВ, … , МК, МN. Кількість молей будь-якого компонента, наприклад К, що припадає на 1 кг суміші, дорівнює
і молекулярні маси відповідно МА, МВ, … , МК, МN. Кількість молей будь-якого компонента, наприклад К, що припадає на 1 кг суміші, дорівнює 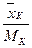 .
.
Відповідно, концентрація цього компонента у мольних частках дорівнює:
 . (1.1.)
. (1.1.)
Для зворотного розрахунку подамо вагові частки  компонентів через мольні частки х. Маси окремих компонентів, що містяться в 1 кмоль суміші, становлять:
компонентів через мольні частки х. Маси окремих компонентів, що містяться в 1 кмоль суміші, становлять:
 ,
,
а загальна маса 1 кмоля дорівнює:
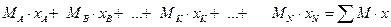
Відповідно, вагова частка компонента K:
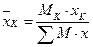 . (1.2.)
. (1.2.)
Об’ємні концентрації і вагові частки.Нехай об’ємні концентрації дорівнюють 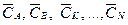 .
.
Сума  – являє собою масу суміші 1 м3 її об’єму або густину
– являє собою масу суміші 1 м3 її об’єму або густину 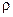 . Тому вагова частка будь-якого компонента дорівнює
. Тому вагова частка будь-якого компонента дорівнює  . Перехід від одних концентрацій до інших наводиться в табл. 1.2.
. Перехід від одних концентрацій до інших наводиться в табл. 1.2.
1.2. Рівновага під час масоперенесення
Правило фаз.Знання рівноваги в процесах масоперенесення дає змогу встановити границі, до яких можуть проходити ці процеси. В основу рівноваги покладено відоме правило фаз.
 ,
,
де Ф – кількість фаз; К – кількість компонентів; С – кількість ступенів свободи або незалежних змінних, значення яких можна змінювати без порушення кількості і виду фаз у системі. За правилом фаз визначають кількість параметрів, які можна змінювати довільно в процесах масообміну. Застосуємо правило фаз до двох груп процесів:
а) кожна з двох фаз містить, окрім розподілюваної речовини інертний носій (абсорбція);
б) в кожній із двох фаз компонент-носій відсутній (ректифікація).
У першому випадку система складається із двох фаз (Ф = 2), трьох компонентів – розподілюваної речовини і двох речовин-носіїв (К = 3).
За правилом фаз:
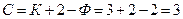 .
.
Отже, кількість ступенів свободи дорівнює загальній кількості компонентів, зокрема компонентів-носіїв. У цьому випадку можна довільно змінювати загальний тиск Р, температуру t і концентрацію однієї із фаз за розподілюваним компонентом (ХА або YA). Відповідно, за певної температури (t = constip = const), деякій концентрації однієї з фаз строго відповідає концентрація іншої фази.
У другому випадку система складається із двох фаз (Ф = 2) і двох розподілених компонентів (К = 2), і, відповідно, має тільки два ступені свободи:

Беручи до уваги, що процеси масоперенесення відбуваються переважно за постійного тиску (Р = const), можна зробити висновок, що у цьому випадку із зміною концентрації ХА повинна змінюватись температура. Разом з тим, якщо температура була б постійною (t = const), то різним концентраціям фази відповідали б різні тиски в системі.
Залежності між незалежними змінними можуть бути зображені в плоских координатах за допомогою фазових діаграм. Наприклад, при t = const XA = f (P), а при P = const XA = ψ(t).
Газова рівновага. Лінія рівноваги.Як приклад розглянемо процес масоперенесення, за яким аміак є розподілюваним компонентом і поглинається із його суміші з повітря чистою водою, а за відхилення від стану рівноваги переходить із газової фази Фу, де його концентрація 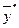 , в рідку фазу ФХ , яка має початкову концентрацію
, в рідку фазу ФХ , яка має початкову концентрацію  = 0.
= 0.
З початком розчинення аміаку у воді починається перехід частини його молекул у зворотному напрямку із швидкістю, пропорційною до концентрації аміаку у воді і на границі розділу фаз. З часом швидкість переходу аміаку у воду буде знижуватися, а швидкість зворотного переходу зростати, причому такий двосторонній перехід продовжуватиметься доти, доки швидкості перенесення в обох напрямках не зрівняються. За рівності швидкостей встановиться динамічна рівновага, за якої не відбуватиметься фактичного переходу речовини із однієї фази в іншу.
За рівноваги досягається певна залежність між рівноважними концентраціями розподільної речовини у фазах для певної температури і тиску, за яких відбувається процес масоперенесення. При динамічній рівновазі не переходить речовина із фази у фазу.
В умовах рівноваги деякому значенню x відповідає строго визначена рівноважна концентрація в іншій фазі  *. Відповідно концентрації
*. Відповідно концентрації  відповідає рівноважна концентрація
відповідає рівноважна концентрація  *. У загальному вигляді зв'язок між рівноважними концентраціями виражається залежністю:
*. У загальному вигляді зв'язок між рівноважними концентраціями виражається залежністю:
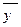 * = f (
* = f (  );
);  * = f1(
* = f1(  )
)
Будь-яка із цих залежностей зображається графічно лінією рівноваги, яка, як правило, є кривою і в часткових випадках – прямою лінією.
Рівновага для системи з компонентами (носіями) при Р = const; t = const виражається кривою, показаною на рис.1.1. (наприклад, процес абсорбції).
Рівноважна крива для процесу ректифікації при Р=const показана на рис. 1.2. Кожній точці відповідає різна температура, як показано на рис.1.2.
Відношення концентрацій фаз при рівновазі називається коефіцієнтом розподілу.
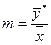 .
.
Коефіцієнт розподілу (т) – це тангенс кута нахилу лінії рівноваги і для кривої лінії рівноваги є величиною змінною. Рівноважні залежності для різних процесів масоперенесення є різними. Наприклад, при абсорбції за низьких концентрацій розподілюваного компонента криві рівноваги описуються законом Генрі; для ідеальних розчинів в процесі ректифікації – законом Рауля.
 | |||
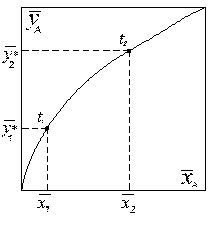 | |||
| Рис. 1.1. Діаграма рівноваги. При Р = const; t = const, C = 3 | Рис. 1.2. Діаграма рівноваги. При Р = const, C = 2 |
На основі рівноважної і робочої ліній можна визначити рушійну силу масоперенесення в будь-якій точці апарата, середню рушійну силу, а за нею і швидкість процесу.
Але переважно криві рівноваги будуються на основі експериментальних даних.
Маючи лінію рівноваги для конкретного процесу і робочу лінію, тобто нерівноважні концентрації фаз у відповідних точках, можна визначити напрям і рушійну силу масоперенесення у будь-якій точці апарата. На основі цих даних може бути визначена середня рушійна сила, а за нею – і швидкість процесу масоперенесення.
Рис. 1.3. До виведення
| |||
Матеріальний баланс і робоча лінія.Залежність між робочими концентраціями розподілюваної речовини у фазах 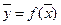 зображається так званою робочою лінією. Загальний вигляд робочої лінії є однаковим для всіх процесів масоперенесення. Розглянемо схему масообмінного апарату, який працює в режимі ідеального витіснення за умов противотоку фаз (рис. 1.3).
зображається так званою робочою лінією. Загальний вигляд робочої лінії є однаковим для всіх процесів масоперенесення. Розглянемо схему масообмінного апарату, який працює в режимі ідеального витіснення за умов противотоку фаз (рис. 1.3).
Згори в апарат надходить L кг/с рідкої фази, яка має початкову масову концентрацію 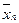 і кінцеву
і кінцеву 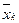 . Знизу в апарат надходить G кг/с газоподібної фази з масовими концентраціями
. Знизу в апарат надходить G кг/с газоподібної фази з масовими концентраціями  і
і 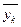 .
.
Матеріальний баланс за всіма компонентами:
Gn + Ln = Gк + Lк,
а за розподільним компонентом:
 ,
,
Напишемо рівняння матеріального балансу для частини апарата (від нижньої частини до середини апарата)
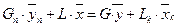 ,
,
А за всією речовиною
Gn + L = Lk + G.
Розв’язуючи відносно  :
:
 ;
;
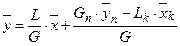 . (1.3.)
. (1.3.)
Ця залежність визначає рівняння робочої лінії, що виражає зв’язок між робочими концентраціями розподільного компонента за фазами для довільного перерізу апарату.
Напрям масоперенесення.Розподільна речовина завжди переходить із фази, де її вміст вищий за рівноважну у фазу, в якій концентрація нижча за рівноважну.
Якщо робоча лінія розміщена нижче лінії рівноваги і масоперенесення проходить між двома фазами Фх і Фу (рис. 1.4а), то для будь-якої точки, наприклад, т. А,
 і
і 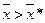 ,
,
де 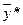 і
і  – рівноважні концентрації. Розподілюваний компонент у цьому випадку переходитиме із фази Фх в фазу Фу.
– рівноважні концентрації. Розподілюваний компонент у цьому випадку переходитиме із фази Фх в фазу Фу.
Якщо робоча лінія розміщена вище лінії рівноваги (рис. 1.4б), то для довільно вибраної точки А концентрація 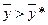 , а концентрація
, а концентрація  (адсорбція).
(адсорбція).
 а
а
| б |
| Рис. 1.4. Визначення напряму масоперенесення за у – х діаграмою: а – робоча лінія, нижча за лінію рівноваги; б – робоча лінія, вища за лінію рівноваги |
При цьому розподілюваний компонент переходитиме із фази Фу в фазу Фх.
Отже, напрям масоперенесення на 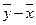 – діаграмі можна визначити за взаємним розміщенням робочої та рівноважної ліній.
– діаграмі можна визначити за взаємним розміщенням робочої та рівноважної ліній.
1.3. Швидкість масоперенесення
Швидкість масоперенесення пов’язана з механізмом перенесення розподілюваної речовини в фазах, між якими проходить масообмін. Перенесення речовини в самій фазі може проходити шляхом молекулярної дифузії або шляхом конвекції і молекулярної дифузії одночасно. Шляхом однієї молекулярної дифузії речовина переміщається лише в нерухомому середовищі. У рухомому середовищі перенесення речовини здійснюється як молекулярною дифузією, так і самим середовищем у напрямку його руху, а також окремими частинами середовища в різних напрямках.
У турбулентному потоці перенесення молекулярною дифузією домінує тільки біля границі фази. Конвективне перенесення речовини, яке здійснюється під дією турбулентних пульсацій, часто називають турбулентною дифузією.
Молекулярна дифузія.Молекулярною дифузією називається перенесення розподілюваної рідини, яке обумовлене хаотичним рухом самих молекул. Молекулярна дифузія описується першим законом Фіка, за яким кількість речовини dM, яка продифундувала за час dτ через елементарну поверхню dF, пропорційна градієнту концентрації dc/dn цієї речовини:
d M = – D × dF × dτ ×  , (1.4)
, (1.4)
або M = -D × F × τ ×  . (1.4 а)
. (1.4 а)
Швидкість молекулярної дифузії (або питомий потік речовини) через F = 1 i τ = 1 дорівнює:
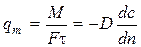 (1.5)
(1.5)
За своєю структурою закон Фіка аналогічний закону Фур’є. Градієнт концентрацій являє собою зміну концентрації речовини, яка дифундує на одиницю нормалі між двома поверхнями, постійних, але різних концентрацій.
Величину D, яка входить у вираз закону Фіка, називають коефіцієнтом молекулярної дифузії, або коефіцієнтом дифузії. Знак “–” перед правою частиною першого закону Фіка вказує на те, що молекулярна дифузія завжди проходить у напрямку зменшення концентрації розподільної речовини. За рівнянням:
 .
.
Коефіцієнт молекулярної дифузії показує, яка кількість речовини дифундує в одиницю часу через одиницю поверхні при градієнті концентрацій, що дорівнює одиниці. Коефіцієнт молекулярної дифузії – це фізична константа, яка характеризує здатність певної речовини проникати внаслідок дифузії у нерухоме середовище. Величина D не залежить від гідродинамічних умов, в яких проходить процес.
Значення коефіцієнта D є функцією властивостей розподілюваної речовини, властивостей середовища, через яке вона дифундує; температури і тиску. Переважно величина D зростає з ростом температури і зниженням тиску. В кожному окремому випадку D визначають з дослідних даних або за теоретичними і напівемпіричними залежностями з врахуванням температури і тиску, за яких проходить процес.
Значення коефіцієнтів дифузії газу в середовище іншого газу мають значення 0,1 – 1 см2/с, а при дифузії газу в рідину вони в 10-4 – 10-5 разів менші, тобто приблизно 1 см2/добу.
Турбулентна дифузія.Кількість речовини, яка переноситься в границях фази внаслідок турбулентної дифузії, становить:
 , (1.6)
, (1.6)
де Еg – коефіцієнт турбулентної дифузії.
Швидкість турбулентної дифузії, або питомий потік речовини, що переноситься шляхом турбулентної дифузії через одиницю поверхні в одиницю часу, становить:
 . (1.7)
. (1.7)
Еg показує, яка кількість речовини подається шляхом турбулентної дифузії в одиницю часу через одиницю поверхні при градієнті концентрацій, що дорівнює одиниці.
Еg = [м2/с].
На відміну від D, коефіцієнт турбулентної дифузії не є фізичною константою і залежить від гідродинамічних умов, які визначаються переважно швидкістю потоку і масштабом турбулентності.
 Конвективне перенесення. Сумарне перенесення речовини в рухомому середовищі за аналогією з теплообміном – називають конвективним масообміном (конвективною дифузією). Розподіл концентрацій під час конвективного масообміну визначається у загальному вигляді диференційним рівнянням масообміну у рухомому середовищі.
Конвективне перенесення. Сумарне перенесення речовини в рухомому середовищі за аналогією з теплообміном – називають конвективним масообміном (конвективною дифузією). Розподіл концентрацій під час конвективного масообміну визначається у загальному вигляді диференційним рівнянням масообміну у рухомому середовищі.
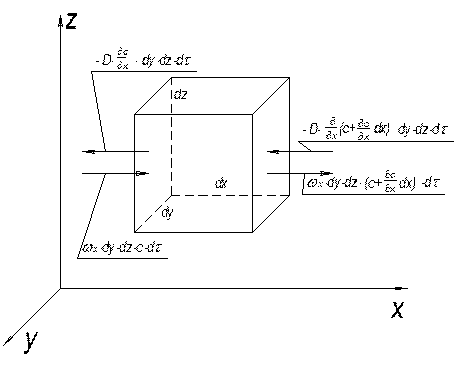
Рис. 1.5. До виведення диференційного рівняння масообміну
у рухомому середовищі
Виділимо в потоці цієї фази елементарний паралелепіпед з ребрами dx, dy, dz, які орієнтовані відносно осей координат (рис. 1.5). Розглянемо матеріальний баланс за речовиною, що розподіляється. Нехай концентрація її в площині dydz дорівнює С, а проекції швидкості на осі координат до цього елемента (точки) потоку –  ,
,  , і
, і  . Кількість речовини, яка надходить шляхом конвективного перенесення через площу dydz, тобто в напрямку осі х, дорівнює:
. Кількість речовини, яка надходить шляхом конвективного перенесення через площу dydz, тобто в напрямку осі х, дорівнює:
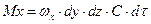 .
.
На протилежному боці паралелепіпеда швидкість у напрямку осі х дорівнює:
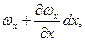
а концентрація розподілу речовини дорівнює: 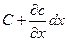 .
.
Відповідно через протилежну грань паралелепіпеда за час dτ виходить за рахунок конвективного теплообміну кількість речовини:
 .
.
Різниця між кількостями речовини, яка пройшла через протилежні грані паралелепіпеда за час dτ d у напрямку осі х, дорівнює
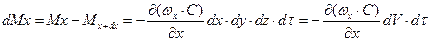 .
.
Аналогічно у напрямку осі z і y:

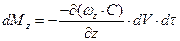 .
.
Вміст розподілюваної речовини в об’ємі паралелепіпеда змінюється за час dτ внаслідок переміщення речовини шляхом конвективного перенесення на величину:
 ,
,
або у розгорненому вигляді:
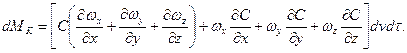
Для нерозривного потоку
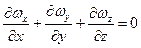 .
.
Тоді рівняння набуде вигляду:
 (А)
(А)
Кількість розподілювальної речовини, що надходить до паралелепіпеда шляхом молекулярної дифузії через грань dzdy, за час dτ становить:
 .
.
Кількість речовини, що виходить із паралелепіпеда за той самий час шляхом молекулярної дифузії, становить:

Різниця між кількостями продифундованого через протилежні грані речовини вздовж осі х шляхом молекулярної дифузії становить:
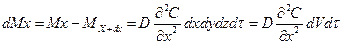 .
.
Аналогічно по осі y і z:
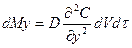 ;
;
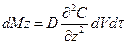
Зміна кількості розподільної речовини в об’ємі всього паралелепіпеда за час dτ при перенесенні молекулярної дифузії змінюється на:
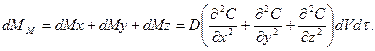 (Б)
(Б)
Зміна кількості розподільної речовини в об’ємі паралелепіпеда (його збільшення або зменшення) повинно компенсуватися підведенням або відведенням такої самої кількості речовини через грані паралелепіпеда шляхом молекулярної дифузії, тобто повинна виконуватися умова:
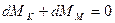 , оскільки при встановленому режимі
, оскільки при встановленому режимі 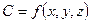 ;
;
 .
.
Відповідно до рівнянь А і Б отримаємо:
 (1.8)
(1.8)
або
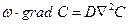 . (1.9)
. (1.9)
Рівняння (1.9.) має назву диференційного рівняння конвективного масообміну в рухомому середовищі і виражає закон розподілення концентрації даного компонента в рухомому середовищі при стаціонарному процесі масообміну.
Для нестаціонарного процесу масообміну (при стаціонарному потоці фаз) ліва частина рівняння (1.8) повинна бути доповнена членом  , який відображає локальну зміну концентрації в часі. Тоді рівняння набуде вигляду:
, який відображає локальну зміну концентрації в часі. Тоді рівняння набуде вигляду:
 . (1.10)
. (1.10)
При масообміні у нерухомому середовищі, коли  , рівняння (1.10) перетворюється на диференціальне рівняння молекулярної дифузії:
, рівняння (1.10) перетворюється на диференціальне рівняння молекулярної дифузії:
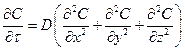 . (1.11)
. (1.11)
Рівняння має назву другого закону Фіка.
У диференціальному рівнянні масообміну в рухомому середовищі, крім концентрації, змінною є швидкість потоку. Тому це рівняння необхідно розглядати сумісно з диференціальним рівняннями гідродинаміки: рівнянням руху – Нав’є – Стокса, і рівнянням нерозривності потоку.
Однак ця система рівнянь не має аналогічного розв’язку, і для отримання розрахункових залежностей за масообміном використовують перетворення диференціального рівняння масообміну в рухомому середовищі методами теорії подібності.
Механізм процесу масоперенесення. Нехай речовина переходить із фази Фу у фазу Фх, де її концентрація вища за рівноважну (рис. 1.6). Насамперед здійснюється процес масовіддачі із основної маси фази Фу до поверхні розділу фаз, а далі від поверхні розділу до основної маси фази Фх. У результаті цих процесів, а також переборення опору перенесення речовини через саму поверхню розділу фази в другу процес масоперенесення є пов’язаним із структурою турбулентного потоку в кожній фазі. Як відомо, при турбулентному потоці біля твердої стінки утворюється ламінарно пограничний шар, тобто в кожній фазі є ядро потоку і пограничний шар біля граничної фази.
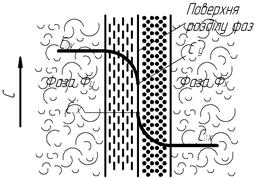
Рис. 1.6. Схема розподілу концентрацій у фазах
у процесах масоперенесення
У ядрі потоку речовина переноситься в основному турбулентними пульсаціями, і концентрація речовини постійна. У пограничному шарі поступово загасає турбулентність. Концентрація за ядром наближена до поверхні розділу фаз. Безпосередньо біля поверхні розділу процес дуже сповільнюється і вже визначається швидкістю молекулярної дифузії. У цій області спостерігається найближча до лінійної зміна концентрації аж до самої поверхні розділу фаз. Такий характер пояснюється дією сил тертя між фазами і сил поверхневого натягу на поверхні фаз розділу фаз (аналогічно до масовіддачі і тепловіддачі).
Отже, при турбулентному русі в ядрі потоку фази перенесення речовини до границі розділу фаз (або в протилежному напрямку і турбулентними дифузіями), причому основна маса речовини переноситься шляхом турбулентної дифузії. В пограничному шарі швидкість перенесення лімітується швидкістю молекулярної дифузії. Для інтенсифікації масоперенесення необхідно зменшити товщину пограничного шару, збільшуючи ступінь турбулентності.
Моделі процесу масоперенесення.Механізм масовіддачі характеризується поєднанням молекулярного та конвективного перенесення. Ще складнішим є процес масоперенесення, який складається з процесів масоперенесення по обидва боки границі розділу фаз. У зв’язку з цим запропонований ряд теоретичних моделей, що являють собою тією чи іншою мірою спрощені схеми механізму масоперенесення:
1. Загальний опір масоперенесення складається з опорів фаз.
2. Опір на границі розділу фаз дорівнює нулю.
3. На поверхні розділу фази знаходяться в рівновазі.
Плівкова модель Нереста. Границю розділу фаз утворюють нерухомі або ламінарно рухомі плівки, в яких перенесення здійснюється лише шляхом молекулярної дифузії. Згідно з плівковою моделлю кількість речовини q, що проходить через одиницю поверхні в одиницю часу, пропорційна різниці концентрацій в ядрі на границі розділу фаз:
 , (1.12)
, (1.12)
де δеф – приведена товщина плівки.
Дослідні дані не підтверджують, що q~D.
Модель дифузійного пограничного шару. За Ландау та Левичем цій моделі відповідає схема розподілу концентрацій в рідкій або газовій фазі, показана на
рис. 1.7 (для системи “рідина (газ) – тверде тіло”).
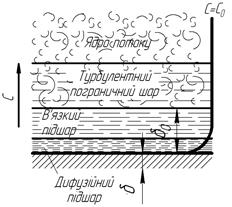
Рис. 1.7. Структура потоку і профіль концентрацій
в фазі (за Ландау і Левичем)
Концентрація речовини, що є сталою в ядрі потоку фази  , повільно знижується в турбулентному пограничному шарі, де спочатку речовина переноситься переважно турбулентними пульсаціями. З наближенням до границі фази і зменшенням масштабу пульсацій на ділянці товщини шару, що названий в’язким підшаром (
, повільно знижується в турбулентному пограничному шарі, де спочатку речовина переноситься переважно турбулентними пульсаціями. З наближенням до границі фази і зменшенням масштабу пульсацій на ділянці товщини шару, що названий в’язким підшаром (  ), концентрація знижується значно швидше. Тут під дією сил тертя рух наближується до ламінарного і збільшується частка речовини, що передається молекулярною дифузією. Проте, на більшій частині товщини в’язкого підшару турбулентною дифузією переноситься більша кількість речовини, ніж молекулярною. Тільки в самій глибині в’язкого підшару в середині тонкого дифузійного підшару завтовшки
), концентрація знижується значно швидше. Тут під дією сил тертя рух наближується до ламінарного і збільшується частка речовини, що передається молекулярною дифузією. Проте, на більшій частині товщини в’язкого підшару турбулентною дифузією переноситься більша кількість речовини, ніж молекулярною. Тільки в самій глибині в’язкого підшару в середині тонкого дифузійного підшару завтовшки  , який знаходиться на границі розділу фаз, молекулярне перенесення стає домінуючим.
, який знаходиться на границі розділу фаз, молекулярне перенесення стає домінуючим.
Дифузійний підшар (рис. 1.7) є шаром найбільш різкої та близької до лінійної зміни концентрацій. Його товщина  зв’язана з товщиною в’язкого підшару
зв’язана з товщиною в’язкого підшару  залежністю:
залежністю: 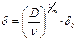 , в якій
, в якій 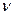 – кінематична в’язкість, m – константа, яка визначається дослідним шляхом.
– кінематична в’язкість, m – константа, яка визначається дослідним шляхом.
Рівняння масовіддачі.Швидкість масовіддачі пропорційна рушійній силі, яка дорівнює різниці концентрацій в ядрі і на границі фази. Відповідно, якщо речовина переходить з фази Фу в фазу Фх, то основне рівняння масовіддачі, яке визначає кількість М речовини, що переноситься в одиницю часу в кожній з фаз (до границі фази або в зворотному напрямі), можна подати так:
Фаза Фу 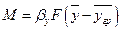 . (1.13)
. (1.13)
Фаза Фх  , (1.13 а)
, (1.13 а)
де βy і βх – коефіцієнти масовіддачі в фазі Фу та в фазі Фх відповідно.
(Примітка: коефіцієнт масовіддачі можна подати в різних одиницях залежно від вибору одиниць для кількості речовини та рушійної сили. У випадку, коли кількість речовини виражена в кг, а рушійна сила в  , коефіцієнт масовіддачі матиме розмірність м/с).
, коефіцієнт масовіддачі матиме розмірність м/с).
 та
та  – рушійна сила процесу масовіддачі відповідно у фазі Фу та в фазі Фх;
– рушійна сила процесу масовіддачі відповідно у фазі Фу та в фазі Фх;
 та
та 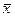 – середні концентрації в основній масі (ядрі) кожної з фаз;
– середні концентрації в основній масі (ядрі) кожної з фаз;
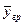 та
та 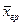 – концентрації у границі відповідної фази.
– концентрації у границі відповідної фази.
Коефіцієнти масовіддачі показують, яка кількість речовини переходить від поверхні розділу фаз в ядро фази (або в зворотному напрямку) через одиницю поверхні в одиницю часу при рушійній силі, яка дорівнює одиниці.
Коефіцієнт масовіддачі є не фізичною константою, а кінетичною характеристикою, що залежить від фізичних властивостей фази (густини, в’язкості та ін.), гідродинамічних умов в ній (режиму руху), а також від геометричних факторів (конструкцій та розмірів масообмінних апаратів).
Отже, величина  є функцією багатьох змінних, що значно ускладнює розрахунок або дослідне визначення коефіцієнтів масовіддачі. Величинами останніх враховується як молекулярне, так і конвективне перенесення речовини в фазі.
є функцією багатьох змінних, що значно ускладнює розрахунок або дослідне визначення коефіцієнтів масовіддачі. Величинами останніх враховується як молекулярне, так і конвективне перенесення речовини в фазі.
За своїм змістом коефіцієнт масовіддачі є аналогом коефіцієнта тепловіддачі в процесах перенесення тепла, а основне рівняння масовіддачі ідентичне за структурою основному рівнянню тепловіддачі.
Подібність процесів перенесення маси.За аналогією з гідродинамічними та тепловими процесами, не розв’язуючи системи диференційних рівнянь, можна методами теорії подібності знайти зв’язок між змінними, що характеризують процес перенесення в потоці фази, у вигляді критеріального рівняння масовіддачі.
До цього рівняння входять критерії подібності, якими описується подібність процесів масовіддачі на границі фази (подібність граничних умов) і в основній масі (ядрі) фази.
Подібність граничних умов можна встановити, допускаючи наявність пограничного шару, в якому процес здійснюється тільки молекулярною дифузією. Кількість речовини, що переходить з ядра до границі фази, відповідно до рівняння масовіддачі (1.13), становить:
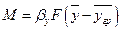 .
.
Така сама кількість речовини переноситься молекулярно й дифузією через пограничний шар і, відповідно, згідно з рівнянням (1.4а) при 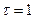 маємо:
маємо:
M = – D × F ×  .
.
Прирівнюючи обидва вирази М та скорочуючи F, знаходимо залежність, що характеризує подібність умов перенесення на границі фази:
 . (1.14)
. (1.14)
Враховуючи, що для таких процесів відношення подібних величин дорівнює відношенню величин їм пропорційних, заміняємо  на
на 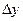 та
та  – деяким характерним лінійним розміром l.
– деяким характерним лінійним розміром l.
Згідно з теорією подібного перетворення рівнянь ділимо ліву частину рівняння на праву, скорочуємо подібні члени та нехтуємо знаком “мінус”. У результаті отримаємо для подібних систем:
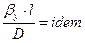 .
.
Такий комплекс має назву дифузійний критерій Нуссельта ( 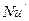 )
)
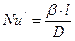 . (1.15)
. (1.15)
Як видно з рівняння (1.15), дифузійний критерій Нуссельта виражає відношення інтенсивності перенесення в ядрі фази до інтенсивності перенесення в дифузійному пограничному підшарі, де вона визначається молекулярною дифузією. Рівність критеріїв 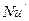 у подібних точках подібних систем виражає подібність процесу перенесення речовин у границі фази в цих системах.
у подібних точках подібних систем виражає подібність процесу перенесення речовин у границі фази в цих системах.
Для встановлення подібності процесів перенесення речовини в ядрі фази розглянемо диференційне рівняння нестаціонарної дифузії в рухомому середовищі (рівняння (1.10)). Для одночасної дифузії маси (наприклад, вздовж осі х) перпендикулярно до напрямку руху середовища вздовж осі z маємо
 . (1.16)
. (1.16)
Член  виражає зміну концентрації в часі, тобто невстановлений характер процесу; член
виражає зміну концентрації в часі, тобто невстановлений характер процесу; член  характеризує розподіл концентрацій, що обумовлений конвективним перенесенням; член
характеризує розподіл концентрацій, що обумовлений конвективним перенесенням; член 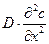 – розподіл концентрацій за рахунок молекулярної дифузії.
– розподіл концентрацій за рахунок молекулярної дифузії.
Заміняємо члени рівняння (1.16) такими величинами:
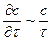 ;
; 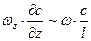 ;
; 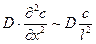 .
.
Ділимо член правої частини рівняння (1.16.) на перший член лівої частини. У результаті отримаємо безрозмірний комплекс:
 , (1.17)
, (1.17)
який має назву дифузійний критерій Фурьє.
Рівність критеріїв 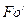 в подібних точках подібних систем – необхідна умова подібності невстановлених процесів масовіддачі. Рівняння (1.17.) характеризує сталість відношення зміни концентрації в часі до зміни концентрації внаслідок суто молекулярного перенесення.
в подібних точках подібних систем – необхідна умова подібності невстановлених процесів масовіддачі. Рівняння (1.17.) характеризує сталість відношення зміни концентрації в часі до зміни концентрації внаслідок суто молекулярного перенесення.
Відношення другої складової лівої частини рівняння (1.16) до його правої частини являє собою безрозмірний комплекс величин, який має назву дифузійний критерій Пеклє:
 . (1.18)
. (1.18)
Критерій  є мірою співвідношення маси речовини, що переміщується шляхом конвективного перенесення та молекулярної дифузії, в подібних точках подібних систем.
є мірою співвідношення маси речовини, що переміщується шляхом конвективного перенесення та молекулярної дифузії, в подібних точках подібних систем.
Подібність розподілення концентрацій та одночасно подібність швидкостей в потоках виконується при таких умовах:
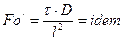 ;
; 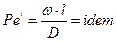 ;
; 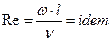 .
.
У багатьох випадках замість критерію  використовують співвідношення критеріїв
використовують співвідношення критеріїв  та Re, яке являє собою дифузійний критерій Прандтля.
та Re, яке являє собою дифузійний критерій Прандтля.
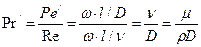 . (1.19)
. (1.19)
До критерію Прандтля входять тільки величини, що відображають фізичні властивості потоку. Отже, цей критерій виражає постійність відношення фізичних властивостей рідини (газу) в подібних точках подібних процесів. Проте, його фізичний зміст значно глибший, тому що в’язкістю 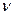 визначається, за інших рівних умов, профіль швидкостей у потоці, а від величини D в кінцевому рахунку залежить розподілення концентрацій. Тому критерій
визначається, за інших рівних умов, профіль швидкостей у потоці, а від величини D в кінцевому рахунку залежить розподілення концентрацій. Тому критерій  розглядається як міра подібності профілів швидкостей і концентрацій в процесах масовіддачі.
розглядається як міра подібності профілів швидкостей і концентрацій в процесах масовіддачі.
При  товщина дифузійного підшару дорівнює товщині гідродинамічного ламінарного підшару.
товщина дифузійного підшару дорівнює товщині гідродинамічного ламінарного підшару.
Необхідною умовою подібності процесів масовіддачі є дотримання гідродинамічної подібності, яке вимагає , щоб в подібних точках подібних потоків були рівними не тільки критерії Рейнольдса ( 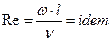 ), але й критерії Фруда (
), але й критерії Фруда (  ). Критерій Фруда зручно замінити (подібно заміні
). Критерій Фруда зручно замінити (подібно заміні  на
на  ) критерієм Галілея, до якого не входить швидкість потоку (
) критерієм Галілея, до якого не входить швидкість потоку ( 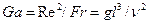 ).
).
За подібності процесів перенесення маси має виконуватись також геометрична подібність, яка виражається рівністю симплексів 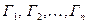 , котрі є відношенням характерних геометричних розмірів
, котрі є відношенням характерних геометричних розмірів  до деякого визначального розміру
до деякого визначального розміру  .
.
Зазвичай визначальною величиною при розрахунках масовіддачі є коефіцієнт масовіддачі  , величину якого знаходять за критерієм
, величину якого знаходять за критерієм 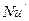 . Відповідно цей критерій можна вважати визначальним.
. Відповідно цей критерій можна вважати визначальним.
Загальна функціональна залежність 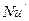 від визначальних критеріїв і симплексів подібності для невстановлених процесів масовіддачі може бути виражена як
від визначальних критеріїв і симплексів подібності для невстановлених процесів масовіддачі може бути виражена як
 (1.20)
(1.20)
або
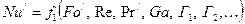 . (1.20а)
. (1.20а)
Для встановлених процесів масовіддачі:
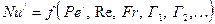 (1.21)
(1.21)
або
 . (1.21а)
. (1.21а)
Залежності (1.20. – 1.21а) можуть мати вигляд степеневого запису. Наприклад, залежність (1.21а) при розгорнутому вигляді критеріїв подібності:
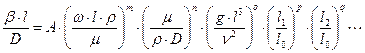 (1.21б)
(1.21б)
Якщо впливом сил тяжіння можна знехтувати, то критерій Ga можна забрати з рівняння (1.21а). Тоді
 (1.22)
(1.22)
Розрахункова залежність типу рівняння (1.20) або (1.21) є критеріальним рівнянням масовіддачі. Числові значення коефіцієнтів A, m, n, o, p, q, що входять до рівняння (1.21б), знаходять узагальненням дослідних даних.
Рівняння масоперенесення
 ; (1.23)
; (1.23)
 , (1.23а)
, (1.23а)
де y*, x* – рівноважні концентрації у цій фазі, які відповідають концентрації речовини, що розподіляється в основній масі іншої фази.
Ку, Кх – коефіцієнти масоперенесення, розмірність яких може бути різна залежно від розмірності концентрації речовини, що переходить з фази в фазу.
Така форма запису рівняння масоперенесення відображає рушійну силу процесу як різницю між робочою та рівноважною концентраціями (або навпаки), тобто відображає частку відхилення системи від стану рівноваги.
Коефіцієнт масоперенесення (Ку , Кх) показує, яка кількість речовини переходить з фази у фазу в одиницю часу через одиницю поверхні контакту фаз при рушійній силі масоперенесення, що дорівнює одиниці.
За фізичним змістом коефіцієнти масоперенесення відрізняються від коефіцієнтів масовіддачі, але виражені з ними в однакових одиницях вимірювання, що залежать від одиниць, в яких виражена рушійна сила і кількість розподільної речовини. Отже, коефіцієнти масоперенесення можуть виражатися в 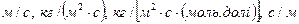 .
.
В умовно прийнятих за рушійну силу різницях концентрацій  або
або  величини
величини  та
та 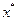 являють собою практично неіснуючі в потоці граничні (рівноважні) концентрації, значення яких можна знайти в довідниках.
являють собою практично неіснуючі в потоці граничні (рівноважні) концентрації, значення яких можна знайти в довідниках.
Концентрації фаз змінюються при їх русі вздовж поверхні розділу фаз, відповідно змінюється рушійна сила масоперенесення. Тому в рівняння масоперенесення вводять величину середньої рушійної сили (  або
або 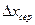 ). Тоді рівняння (1.23) та (1.23а) набудуть вигляду:
). Тоді рівняння (1.23) та (1.23а) набудуть вигляду:
 (1.24)
(1.24)
 (1.24а)
(1.24а)
За допомогою рівнянь (1.24) та (1.24а) зазвичай знаходять поверхню контакту фаз F та за її значенням розраховують основні розміри апарату. Для визначення F необхідно попередньо розрахувати коефіцієнти масоперенесення та середню рушійну силу (див. нижче). Величина М – кількість речовини, що переходить з фази в фазу в одиницю часу, або навантаження апарату, або задається під час розрахунку, або визначається з матеріального балансу.
Зв'язок між коефіцієнтом масовіддачі і масоперенесення.Щоб встановити зв’язок між коефіцієнтом масоперенесення і коефіцієнтами масовіддачі, зазвичай приймають, що на границі розділу фаз (рис. 1.6) досягають рівноваги. Це означає, що опором перенесення через границю розділу фаз можна знехтувати. Звідси виникає положення про адитивність фазових опорів, яке використовується для розрахунку коефіцієнтів масоперенесення.
Розглянемо випадок, коли рівноважна залежність між концентраціями в фазах лінійна, тобто лінія рівноваги описується рівнянням: y* = mx, де m – тангенс кута нахилу лінії рівноваги.
Подамо рушійну силу в рівнянні масовіддачі (1.13а) у концентраціях фази Фу, приймаючи, що концентрації речовини, що розподіляється в фазах, безпосередньо на границі (  ) рівноважні одна одній. Тоді з рівняння лінії рівноваги випливає, що
) рівноважні одна одній. Тоді з рівняння лінії рівноваги випливає, що  та
та 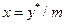 , де, як і вказувалося,
, де, як і вказувалося,  – концентрації на границі кожної фази відповідно і y* – концентрація фази Фу, рівноважна з концентрацією х фази Фх.
– концентрації на границі кожної фази відповідно і y* – концентрація фази Фу, рівноважна з концентрацією х фази Фх.
Підставляючи значення  в рівняння (1.13а), отримаємо
в рівняння (1.13а), отримаємо
 .
.
Звідки
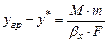 . (А)
. (А)
З рівняння масовіддачі (1.13) маємо:
 . (Б)
. (Б)
Додаючи вирази (Б) та (А) та виключаючи невідому концентрацію на границі розділу фаз, отримаємо:
 .
.
З рівняння масоперенесення (1.24) отримаємо:
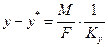 .
.
Прирівнюючі праві частини отриманих виразів рушійної сили  та скорочуючи подібні члени, отримаємо:
та скорочуючи подібні члени, отримаємо:
 .
.
Виражаючи коефіцієнт масоперенесення в концентраціях фази Фх, аналогічні судження приводять до залежності:
 .
.
Отже, отримаємо систему рівнянь:
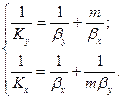 (1.25)
(1.25)
Рівняння (1.25) називаються рівняннями адитивності фазових опорів. Розв’язуючи систему рівнянь (1.25), встановлюємо, що 
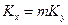 .
.
Ліва частина рівнянь (1.25), що зв’язує коефіцієнт масоперенесення з коефіцієнтом масовіддачі, являє собою загальний опір перенесенню речовини із фази в фазу, тобто опір масоперенесення, а права – суму опорів масовіддачі в фазах. Тому ці рівняння являють собою рівняння адитивності фазових опорів. Рівняння адитивності виведені для лінійної рівноважної залежності, але вони справедливі і для кривої рівноваги.
При кривій лінії рівноваги величини m і відповідно коефіцієнти масоперенесення змінюються за висотою (довжиною) апарата. При його розрахунку розбивають апарат за висотою на ділянки, а в границях кінетичного із них приймають m величиною постійною і використовують середнє для всього апарата значення m.
Дисперсійний опір для кожної з фаз залежить від гідродинамічних умов і величин коефіцієнта дифузії в ній, а також від умов рівноваги. У деяких випадках дифузії опір однієї із фаз може бути дуже малим порівняно з опором другої фази. Нехай опір фази Фх дуже малий. Тоді βх дуже великий, а дифузійний опір 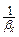 – дуже мала величина. При цьому m член
– дуже мала величина. При цьому m член  величина показника. У такому випадку Ку ~ βу, а швидкість масоперенесення обмежена опором фази Фу , що є визначальним. В другому випадку, коли βу визначна величина, а
величина показника. У такому випадку Ку ~ βу, а швидкість масоперенесення обмежена опором фази Фу , що є визначальним. В другому випадку, коли βу визначна величина, а  – незначна, то Кх ~ βх , тобто визначальним є опір фази Фх. Для збільшення швидкості масоперенесення необхідно збільшувати той коефіцієнт масовіддачі, який лімітує величину К, тобто найменший за величиною коефіцієнт масовіддачі. Це можливо зробити шляхом збільшення турбулізації фази, збільшуючи в певних границях її швидкість.
– незначна, то Кх ~ βх , тобто визначальним є опір фази Фх. Для збільшення швидкості масоперенесення необхідно збільшувати той коефіцієнт масовіддачі, який лімітує величину К, тобто найменший за величиною коефіцієнт масовіддачі. Це можливо зробити шляхом збільшення турбулізації фази, збільшуючи в певних границях її швидкість.
При фіксованих величинах βх і βу величини коефіцієнта масоперенесення визначається нахилом m лінії рівноваги. Якщо нахил m дуже малий, то це означає, що при рівновазі вміст розподільної речовини в фазі Фу значно менший, ніж у фазі Фх Величина  рівнянні
рівнянні  =
=  +
+  дуже мала, і основний опір витрачається складовою
дуже мала, і основний опір витрачається складовою  (наприклад, процес абсорбції добре розчинного у воді газу).
(наприклад, процес абсорбції добре розчинного у воді газу).
При дуже великому m речовина при рівновазі знаходиться в основному в фазі Фу
У цьому випадку  –величина мала, а основний опір процесу масоперенесення знаходиться у фазі Фх (процес абсорбції погано розчинного газу).
–величина мала, а основний опір процесу масоперенесення знаходиться у фазі Фх (процес абсорбції погано розчинного газу).
Об’ємні коефіцієнти масовіддачі і масоперенесення.Поверхню контакта фаз, до одиниці якої віднесені коефіцієнти масовіддачі і масоперенесення, у більшості випадків складно визначити. Тому коефіцієнти масовіддачі і масоперенесення часто відносять не до поверхні контакту фаз F, а до робочого об’єму апарата V, який пов’язаний з поверхнею такою залежністю:
 ,
,
де F – поверхня контакту фаз, м 2; а – питома поверхня контакту фаз, тобто поверхня, віднесена до одиниці робочого об’єму апарата, 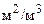 .
.
Підставляючи у рівняння масоперенесення (1.13) та (1.13.а) величину 12345678910Следующая ⇒
