 |
|
Основное уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
Моли разных газов (при неизменных давлении p и температуре Т) занимают равные объёмы, следовательно, для одного моля любого газа
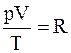 , (11.34)
, (11.34)
где R - универсальная газовая постоянная.
Так как в формуле (11.34) для одного моля B×m = B×m = R, то B = R/m, следовательно, для произвольной массы газа
 или
или  . (11.35)
. (11.35)
Уравнение (11.35) носит название уравнения Менделеева-Клапейрона. Оно является основным уравнением состояния идеального газа.
Для одного моля идеального газа основное уравнение может быть записано так
 . (11.36)
. (11.36)
11.2.2.6. Закон Авогадро
Запишем основное уравнение молекулярно-кинетической теории для двух газов, занимающих одинаковые объемы при одинаковых температурах и давлениях в виде
 , (11.37)
, (11.37)
 , (11.38)
, (11.38)
где  и
и  - кинетические энергии молекул газов, которые ввиду равенства температур одинаковы.
- кинетические энергии молекул газов, которые ввиду равенства температур одинаковы.
Приравняв правые части выражений (11.37) и (11.38), сократив числовые коэффициенты и кинетические энергии, получим
N1 = N2, (11.39)
т.е. в одинаковых объемах при одинаковых температурах и давлениях содержатся одинаковые количества молекул.
Формула (11.39) отображает закон Авогадро.
Число молекул в единице количества вещества (в одном моле) называется числом Авогадро, числовое значение которого NA = 6,023×1023 моль-1.
Закон Дальтона
Из основного уравнения молекулярно-кинетической теории давление газа определяется соотношением
 , (11.40)
, (11.40)
где n0 = N'/V – число молекул в единице объема;
<E'> - средняя кинетическая энергия молекул газа.
Для смеси нескольких газов общее количество молекул газа в единице объема равно сумме количеств молекул в единице объема отдельных газов
n = n01 + n02 + ….. + n0n. (11.41)
Поскольку все газы в смеси находятся при одинаковой температуре, средние кинетические энергии их молекул одинаковы:
<E'1> = <E'2> = ….. = <E'n> = <E'>. (11.42)
Подставив (11.41) в (11.40) и учитывая (11.42), получим
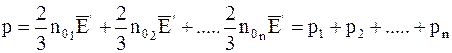 , (11.43)
, (11.43)
т.е. «Давление смеси газов равно сумме парциальных давлений, т.е. тех давлений, которые имел бы каждый из входящих в смесь газов, если бы в объеме, занятом смесью, находился он один».
Формула (11.43) отображает закон Дальтона.
Хотя закон Дальтона справедлив для смеси идеальных газов, но он очень хорошо выполняется в широком диапазоне давлений и температур реальных газов, и поэтому имеет большое практическое значение.