 |
|
Закони ідеальних газів
Характеристики ідеального газу:
1. концентрація молекул приблизно 
2. середня відстань між молекулами 
3. сумарний власний об’єм молекули, що знаходяться в 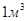 газу складає
газу складає  (даним об’ємом можна знехтувати)
(даним об’ємом можна знехтувати)
На основі експериментів з такими газами було встановлено ряд закономірностей, які виконувались для ідеальних газів обов’язково, а для реальних газів можуть бути виконані лише при певних умовах (не дуже високих температурах і відносно низькому тиску, постій структурі, малих розмірах і низькій концентрації).
Закон Бойля-Маріотта (1662р.)
При постійній температурі об’єм даної маси газу обернено пропорційний його тиску:
 (1)
(1)
c – постійна величина, пропорційна кількості молів газу і його абсолютній температурі
Закон Гей-Люссака (1802р.)
Об’єм даної маси газу при постійному тиску змінюється лінійно з температурою:
 (2)
(2)
 ,
,  - об’ми газу при температурі T і 0
- об’ми газу при температурі T і 0 
 - термічний коефіцієнт розширення при постійному тиску
- термічний коефіцієнт розширення при постійному тиску
Для всіх газів при нормальних умовах:
 (3)
(3)
За абсолютною шкалою температур:
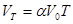 (4)
(4)
Закон Шарля (1787р.)
Тиск даної маси газу при постійному об’мі змінюється лінійно з температурою:
 (5)
(5)
 - тиски газу при температурі Т і 0
- тиски газу при температурі Т і 0 
 - термічний коефіцієнт тиску при постійному об’ємі
- термічний коефіцієнт тиску при постійному об’ємі
Для всіх газів при нормальних умовах 
За абсолютною шкалою температур:
 (6)
(6)
Закон Авогадро
Гей-Люссак сформулював закон з’днаних об’ємів для газів: об’єм газів, що реагують або що утворюються у результаті хімічних реакцій, знаходяться у відношеннях невеликих цілих чисел. Авогадро висунув гіпотезу, що в рівних об’ємах різних газів при однаковій температурі і тиску знаходиться однакове число молекул.
Один моль будь-якого газу, який є подібним до ідеального газу при однаковій температурі і тиску, займає однаковий об’єм
При нормальних умовах даний об’єм:
