|
|
Другий закон термодинаміки
У 1924 році французький вчений Карно стверджував: будь-яка теплова машина окрім нагрівача і робочого тіла повинна мати холодильник, де температура холодильника менша за температуру нагрівача. Усі виводи Карно виражають другий закон термодигаміки.
Перше формулювання другого закону термодинаміки було сформоване у 1850 році Клаузіусом: неможливий такий процес, при якому теплота самовільно переходила б від тіл більш холодних до тіл більш нагрітих.
Незалежно від Клаузіуса, англійський фізик Томпсон у 1861 році сформулював інше формулювання: неможливий круговий процес, єдиним результатом якого було б виконання роботи за рахунок охолодження теплового резервуара (тіла або системи тіл, що знаходяться в стані термодинамічної рівноваги і володіють запасом внутрішньої енергії). Згідно з Томпсоном: вічний двигун другого роду неможливий.
Другий закон термодинаміки: ентропія замкненої системи при будь-якому реальному процесі або збільшується, або залишається незмінною ( 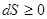 ).
).
В стані ріноваги ентропія досягає максимуму і ніякі макропроцеси неможливі.
Не дивлячись на свою загальність, другий закон термодинаміки не має абсолютного характеру і відхилення від нього є закономірним, наприклад, броунівський рух важких честинок, або рівновісне теплове випромінення великих тіл або самостійна зміна температури і тиску в рівновісній системі та інше.

Кристали та їх властивості
1. Будова кристалу
2. Класи і типи кристалів
3. Дефекти в кристалах
4. Теплоємність кристалів
Будова кристалу
Більшість твердих тіл в природі маюьб крсталічну будову.
Характерна риса кристалічного стану, що відрізняє його від рідкого і газоподібного стану є наявність анізотропії – залежності ряду фізичних властивостей (механічних, теплових, електричних, оптичних) від напряму.
Тіла, властивості яких однакові у всіх напрямках, називаються ізотропними. Ізотропи, окрім газів і, за окремими виключеннями, всіх рідин, також аморфні тверді тіла (які представляють собою переохолоджені рідини).
Причиною анізотропії кристалів служить впорядковане розташування частинок (атомів чи молекул), з яких вони складаються. Впорядковане розташування частинок проявляється у правильній зовнішній огранці кристалів. Кристали обмежені плоскими гранями, що перетинаються під деякими, визначеними для кожного даного роду кристалів, кутами. Розколювання кристалів може легше відбуватися по визначеним площинам, що називаються площинами спайності.
Правильність геометричної форми і анізотропія кристалів зазвичай не проявлябться, оскільки кристалічні тіла зустрічаються, як правило у вигляді полікристалів – конгломератів багатьох, зрісшихся між собою хаотично щрієнтованих дрібних кристалів. В полікристалах анізотропія спостерігається лише в межах кожного окремо взятого кристала, тіло ж вцілому внаслідок хаотичної орієнації кристалів, анізотропію не виявляє.
Створивши спеціальні умови кристалізації з розплаву чи розчину, можна отримати великі одиночні кристали – монокристали будь-якої речовини.