 |
|
Класи і типи кристалів
Кристалічна гратка, як правило, має одночасно декілька видів симетрії. Проте не кожне сполучення елементів симетрії виявляється можливим. Можливі 230 комбінацій елементів симетрії, що отримали назву просторових груп. Ці 230 просторових груп за ознаками симетрії розбиваються на 32 класи. І нарешті, за формою елементарної комірки всі кристали поділяють на 7 кристалографічних систем (або сингоній), кожна з яких включає в себе декілька класів симетрії.
В порядку зростання симетрії кристалографічні системи розташовані наступним чином:
1. Триклічна система


Елеменарна комірка має форму косокутного паралелепіпеда
2. Моноклінна система


Пряма призма, в основі якої лежить паралелогра (тобто прямий паралелепіпед)
3. Ромбічна система
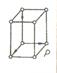

Прямокутнй паралелепіпед
4. Тетрагональна система


Пряма призма з квадратом в основі
5. Ромбоедрична (тригональна) система


Куб, деформований стисканням, або розтагом вздовж діагоналі
6. Гексагональна система
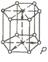

Якщо скласти разом три елементарні комірки, то одержимо правильну шестигранну призму
7. Кубічна система


В залежності від природи частинок, що мвстяться у вузлах кристалічних граток і від характеру сил взаємодії між частинками розрізняють 4 типи кристалічних граток і відповідно, 4 типи кристалів: іонні, атомні, металічні та молекулярні.
1. іонні кристали (NaCl – кам’яна сіль). У вузлах кристалічних граток – іони різних знаків. Сили взаємодії переважно електростатичні (кулонівські).
Зв’язок обумовлений електростатичними чилами притягання між різнойменно зарядженими іонами називається гетерополярним (або іонним).
2. атомні кристали (алмаз, графіт). У вузлах кристалічні гратки - нейтральні атоми.
Зв’язок, що об’єднує в кристалі (а також в молекулі) нейтральні атоми, називаються гомеополярним (або ковалентним).
Сили взаємодії при гомеополярному зв’язку також мабть кулонівський характер.
Кожний іон діє на всі достатьо близькі до нього йони. Дія направлена на той атом, з яким у даного атома є спільна електронна пара.
Гомеополярний зв’язок здійснюється лише валентними (найменш зв’язаними з атомом) електронами. Оскільки кожен електрон може забезпечити зв’язок лише з одним атомом, число зв’язків, в яких може брати участ даний атом, дорівнює його валентності.
3. металічні кристали. У всіх вузлах кристалічної гратки – позитивні йони металу, між ними хаотично подібно до молекул газу, рухаються електрони, відщеплені від атомів при утворенні іонів. Ці електрони грають роль ”цементу”, утримуючи разом позитивні йони; в супротивному випадку гратка розпалася б піл дією сил відштовхування між йонами.
Разом з тим, і електрони утримуються йонами в межах гратки і не можуть її покинути.
4.молекулярні кристали. У вузлах кристалічної гратки поміщені невним чином орієнтоваі молекули. Сили зв’язку між молекулами в кристалі мають ту саму природу, що й сили притагання між молекулами, яка призводять до відхиленя газів від ідеальності. По цій причині, їх називають ван-дер-вальсовськими силами.