 |
|
Теплота. Робота. Теплоємність
При взаємодії термодинамічної системи з зовнішніми тілами, є два способи зміни енергії цієї системи:
1. здійснення якоїсь роботи
2. здійснення теплообміну
Тому кажуть, що обмін енергією між системою і зовнішніми тілами відбувається у вигляді роботи, або у вигляді теплоти.
Робота А – кількісна міра енергії, яка витрачається системою для обміну із зовнішніми тілами в результаті механічної взаємодії з ними.
За визначенням робота А дорівнює добутку сили на шлях:

Виконання роботи над макроскопічною нерухомою системою означає, що повинні рухатись зовнішні тіла, що діють на систему, тобто повинні змінюватись форма і об’єм системи.
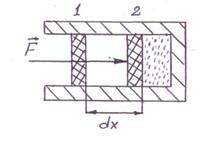
Наприклад, якщо взяти газ у деякому циліндрі з поршнем в положенні 1, що переміщується в положення 2, при переміщенні поршня на dx буде виконана робота dA:
 (3)
(3)
При переміщенні поршня з положення 1 в положення 2 буде виконуватись робота:
 (4)
(4)

При переході системи з стану 1 в стан 2, робота залежить від способу переходу. Робота процесу переходу з 1 в 2 через різні стани (а) і (б) не буде однаковою, а результуюча робота повного процесу 1(а)2(б)1 не дорівнює нулю, а буде пропорційна заштрихованій фігурі (заштрихованій площі) і можна записати :
 (5)
(5)
Із сказаного слідує, що елементарна робота не є повним диференціалом, а сама робота А не є функцією стану системи.
Теплота – міра енергії, якою система обмінюється з зовнішніми тілами шляхом теплопередачі без механічної роботи. Передача енергії у вимірюванні теплоти може відбуватися слідуючими способами:
1. конвекційним
2. теплопровідністю (як теплообін при контакті тіл)
3. теплообмінним випромінюванням (потік сонячної енергії)
Якщо система виходить з початкоого стану, а потім повертається в нього, то повна зміна теплоти не завжди дорівнює нулю:
 (6)
(6)
Кількість теплоти не є повним диференціалом, а робота не є функцією стану системи, таким чином на відміну від внутрішньої енергії, яка є однозначною функцією стану системи, поняття теплоти і роботи мають зміст лише у зв’язку з процесом переходу. Вони є енергетичними характеристиками цього процесу. Теплоту і роботу можна розглядати як способи обміну енергії між тілами, а не як різні форми енергії. Обидва ці способи обміну енергією нерівноцінні, але в реальних умовах завжди супроводжують один одного.
Здійснення роботи над системами може призвести до зміни будь-якого виду енергії, в тому числі кінетичної енергії поступального руху мікроскопічної системи, а значить і до зміни температури системи.
При нагріванні тіла розширюються, а це значить, що робота, яка здійснюється направлена проти зовнішнії сил.
Для характеристики теплових характеристик тіл використовуються поняття теплоємність. Теплоємність – відношення кількості теплоти, яка отримана тілом при нескінченно малій зміні його температури до цієї зміни:
 (7)
(7)
Теплоємність тіла залежить від його хімічного складу, маси, термодинамічного стану і від виду процесу зміни стану тіла при наданні йому кількості теплоти  Q.
Q.
Для однорідних тіл краще користуватися поняттям питомої та мольної теплоємності.
Під питомою теплоємністю розуміють теплоємність одиниці маси речовини:
 (8)
(8)
Молярна – теплоємність 1 моля речовини:
 (9)
(9)
На основі рівнянь (7) і (9), кількість теплоти, яка надана тілу при зміні його температури на величину dT:
 (10)
(10)
Залежність теплоємності від виду процесу зміни стану в системі детальніше розглянемо при вивченні ізопроцесів ідеального газу.