 |
|
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ГАЗА МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
Цель работы: определить отношение теплоемкостей газа методом адиабатического расширения.
Приборы и принадлежности: установка ФПТ1-6 (закрытый стеклянный баллон, U- образный водяной манометр, насос).
Теоретические сведения
Всякое тело, состоящее из большого числа частиц, называется макроскопической системой. Ее размеры всегда значительно больше размеров атомов и молекул. Термодинамика, как раздел физики, изучает закономерности теплового движения в равновесных макроскопических системах и процессы перехода от одних равновесных термодинамических состояний к другим.
Под термодинамической системойпонимают совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой). Ее состояниезадается термодинамическими параметрами (параметрами состояния)– совокупностью физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают температуру (T), давление (p), объем (V). Равновеснымназывается такое состояние системы, при котором все ее параметры имеют определенные значения, остающиеся неизменными сколь угодно долго при постоянных внешних условиях.
Между этими параметрами существует функциональная зависимость: при изменении одного из них меняются другие. Эта зависимость выражается соотношением, называемым уравнением состояния. Для идеального газа, простейшей термодинамической системы, уравнение состояния получено на основе двух опытных газовых законов: Бойля-Мариотта и Гей-Люссака.
Идеальный газ - это разреженный газ, в котором взаимодействие между молекулами не учитывается, столкновения их считаются абсолютно упругими, а объем молекул бесконечно мал по сравнению с объемом, занимаемым газом. Уравнение состояния идеального газа- это уравнение Клайперона-Менделеева, которое для газа массой m с молекулярной массой М, имеет вид:
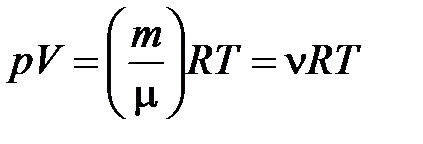 .
.
Для газа массой, равной его молекулярному весу, т.е. для одного моля газа (n = 1моль):
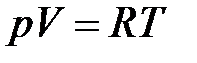 ,
,
где R ˗ универсальная постоянная, составляющая 8,314 Дж/(моль К).
Реальные газы при нормальных условиях могут быть с достаточной степенью точности описаны с помощью уравнений для идеального газа.
Первое начало термодинамики представляет собой принцип сохранения энергии для термодинамических систем, полученный на основе многократных измерений соотношения между количеством теплоты, получаемым за счет работы, и ее величиной. Количество теплоты dQ, сообщенное системе в ходе теплообмена, идет на приращение ее внутренней энергии (кинетической энергии молекул) dU и совершение работы над внешними телами dA:
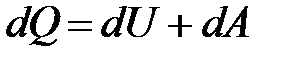 .
.
В отличие от твердых и жидких тел газы могут значительно изменять свой объем. При этом совершается механическая работа. Если объем газа изменился на некоторую малую величину dV, то он совершил работу dА, равную произведению pdV. При расширении газа работа положительна, при сжатии – отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа рассчитывается по формуле
 .
.
Она численно равна площади фигуры под кривой, описывающей процесс на (p,V) ˗ диаграмме. Величина работы зависит от того, как осуществлялся переход из начального в конечное состояние.
Процесс в термодинамике определяется как переход системы из одного состояния в другое. Для газа, например, это переход из состояния, определяемого параметрами p1,V1,T1 в состояние с параметрами p2,V2,T2. Процессы, в которых один из параметров остается неизменным, называют изопроцессами.
Изобарныйпроцесс – это процесс квазистатического расширения или сжатия вещества (в данном случае - идеального газа), происходящий при постоянном давлении p. На плоскости (V, T) изобарные процессы при разных значениях давления изображаются семейством прямых линий V ~ T (закон Гей-Люссака). Для одного моля идеального газа: 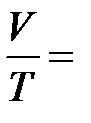 const
const  Работа газа выражается соотношением:
Работа газа выражается соотношением:
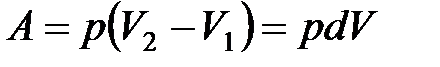 .
.
Первое начало термодинамики можно записать в виде
 .
.
При изобарном расширении Q > 0, т.е. тепло поглощается, газ совершает положительную работу. При изобарном сжатии Q < 0.
Изотермический процесс – это процесс квазистатического расширения или сжатия вещества, находящегося в контакте с тепловым резервуаром (Т=const). На плоскости (p,V) эти процессы при различных значениях температуры Т изображаются семейством гипербол p ~  (закон Бойля-Мариотта). Для одного моля идеального газа:
(закон Бойля-Мариотта). Для одного моля идеального газа: 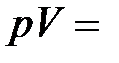 const
const  . Работа для молей ν газа при изменении объема от V1 до V2 может быть найдена по формуле
. Работа для молей ν газа при изменении объема от V1 до V2 может быть найдена по формуле
 .
.
Так как внутренняя энергия U идеального газа зависит только от температуры, первое начало термодинамики для изотермического процесса запишется в виде: dQ = dA. Количество теплоты dQ, полученное от теплового резервуара, идет на совершение работы dA. В случае сжатия работа внешних сил, произведенная над газом, превращается в тепло, поглощаемое тепловым резервуаром.
Изохорныйпроцесс – это процесс квазистатического нагревания или охлаждения вещества (в данном случае - идеального газа), происходящий при постоянном объеме V. На плоскости (p,T) изохорические процессы при разных значениях объема изображаются семейством прямых линий p ~ T (закон Шарля). Для одного моля идеального газа: 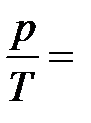 const
const 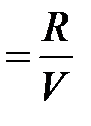 . В изохорном процессе газ не совершает работу (А=0). Первое начало термодинамики в этом случае записывается в виде
. В изохорном процессе газ не совершает работу (А=0). Первое начало термодинамики в этом случае записывается в виде
 ,
,
где U(T1), U(T2) – внутренняя энергия газа в начальном и конечном состояниях. При изохорном нагревании тепло поглощается газом (dQ > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (dQ < 0), и внутренняя энергия газа уменьшается.
Тепловые свойства однородных тел в термодинамике характеризуются теплоемкостью.
Удельной теплоемкостью вещества Суд называется физическая величина, численно равная количеству тепла, которое надо сообщить единице массы этого вещества, чтобы увеличить его температуру на 1°С.
Для газов удобно пользоваться молярной теплоемкостью См, которая характеризуется количеством тепла, необходимым для нагревания одного моля вещества на 1°С. Очевидно,  .
.
Величина теплоемкости газа зависит от его химического состава и вида термодинамического процесса, изменяющего состояние газа. Выясним эту зависимость с помощью уравнения состояния идеального газа и первого начала термодинамики. Пусть Cv и Cp - молярная теплоемкость газа в изохорном процессе (при постоянном объеме) и в изобарном процессе (при постоянном давлении) соответственно. Между этими параметрами существует соотношение Майера:
 =
= 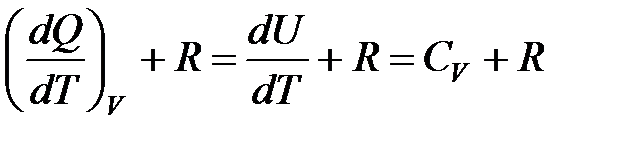 .
.
Физический смысл R состоит в том, что она численно равна работе, которую совершает 1 моль газа в результате его расширения при постоянном давлении с повышением температуры на 1°С.
Если учесть, что внутренняя энергия моля идеального газа определяется только температурой и числом степеней свободы (i) молекул, входящих в состав этого газа, то получаем:
 ,
,
 .
.
Отношение  является константой (в определенном диапазоне температур), называемой показателем адиабаты.
является константой (в определенном диапазоне температур), называемой показателем адиабаты.
Формула  устанавливает связь показателя адиабаты g и числа степеней свободы i молекулы газа.
устанавливает связь показателя адиабаты g и числа степеней свободы i молекулы газа.
Адиабатическимназывается процесс, происходящий без теплообмена системы с внешней средой (dQ = 0). Отсюда следует, что при адиабатическом процессе работа может производиться лишь за счет изменения внутренней энергии системы: 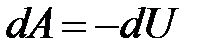 .
.
Для протекания адиабатического процесса система должна быть окружена абсолютно нетеплопроводными стенками. Но так как этого достичь нельзя, то всякий реальный процесс может происходить лишь как более или менее точное приближение к адиабатическому. Практически близкими к адиабатическому оказываются процессы, протекающие настолько быстро, что теплообмен с внешней средой не успевает произойти.
Уравнение адиабаты (уравнение Пуассона):
 const. (1)
const. (1)
Диаграмма данного процесса в координатах (p,V) имеет вид гиперболы, более крутой, чем гипербола изотермического процесса. Это объясняется тем, что при адиабатическом сжатии увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.
Работа, совершаемая газом в ходе данного процесса, вычисляется по формуле
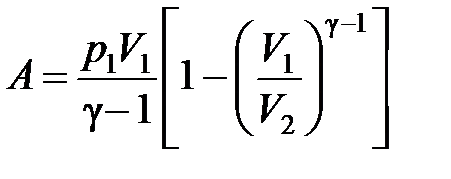 ,
,
где  .
.
Непосредственное экспериментальное определение теплоемкостей газа Ср и Cv затруднительно, т.к. они составляют ничтожную долю теплоемкости сосуда, заключающего газ. Обычно измеряют 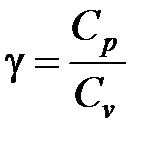 , которое входит в уравнение Пуассона. Поэтому в настоящей работе для определения γ предлагается метод адиабатического расширения газа (метод Клемана-Дезорма).
, которое входит в уравнение Пуассона. Поэтому в настоящей работе для определения γ предлагается метод адиабатического расширения газа (метод Клемана-Дезорма).
Описание установки
Используемая установка (рис.1) состоит из баллона с газом, соединенного с манометром и насосом (микрокомпрессором). Если при помощи насоса накачать в баллон некоторое количество воздуха, то его давление и температура повысятся. На диаграмме (рис.2) этот процесс представляется изотермой М3М1. После накачивания вследствие теплообмена с окружающей средой температура воздуха в баллоне через некоторое время сравняется с температурой окружающей среды. Давление p1, установившееся в баллоне, больше атмосферного на величину давления столба жидкости высотой h1, определяемую разностью уровней жидкости в коленах манометра.
Если обозначить через m массу воздуха в баллоне при атмосферном давлении, то при давлении p1 воздух займет меньший объем, чем объем сосуда. Обозначим этот объем через V1. Тогда состояние воздуха массой m внутри баллона будет характеризоваться параметрами p1,V1, Т1 = Ткомн. На рис.2 данному состоянию соответствует точка M1. Если открыть на короткое время клапан (пневмотумблер), то воздух в баллоне расширится. Давление внутри баллона в конце расширения равно атмосферному (p0), объем рассматриваемой массы воздуха равен объему сосуда V2.

| 
|
| Рис. 1 | Рис. 2 |
Так как процесс быстрого расширения воздуха можно считать адиабатическим, то температура Т2 станет ниже комнатной (работа расширения совершается за счет внутренней энергии газа). Следовательно, в конце адиабатического расширения (точка М2 на рис.2) параметры будут p0, V2, Т2.
Применяя к этим состояниям уравнение Пуассона (1), получим
 . (2)
. (2)
Закроем клапан. Охладившийся при расширении воздух в баллоне через некоторое время вследствие теплообмена нагреется до комнатной температуры (процесс нагревания является изохорическим). Это приведет к возрастанию давления воздуха до некоторой величины p2. Поэтому давление будет больше атмосферного на величину давлениястолба h2, определяемую разностью уровней жидкости в коленах манометра. Параметры этого состояния: p2, V2, Т1 = Ткомн (точка М3).
Начальное и конечное состояния газа наблюдаются при одинаковой температуре, поэтому на основании закона Бойля-Мариотта можно записать:
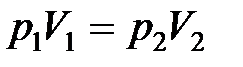 .
.
На графике (рис.2) показаны процессы перехода газа из одного состояния в другое. Переход М1М2 - адиабата, М2М3 - изохора, М1М3 -изотерма.
Найдем значение γ. Для этого обе части уравнения (2) возведем в степень γ:
 . (3)
. (3)
Затем разделим уравнение (3) на уравнение (2) и полученное выражение прологарифмируем.
 .
.
Зная, что p0 – атмосферное давление, а давления p1 и p2 превышают атмосферное соответственно на величину давления столбов жидкости в манометре высотой h1 и h2, т.е. p1 = p0 + ρgh1, p2 = p0 + ρgh2, где ρ – плотность жидкости; g – ускорение свободного падения, получаем:
 . (4)
. (4)
Формула (4) является расчетной для определения γ. Разности уровней жидкости h1 и h2 измеряются непосредственно из опыта.
Порядок выполнения работы
1. Включить сеть (тумблер 1).
2. Проверить закрытие воздушного клапана (повернуть красное колесико по часовой стрелке до щелчка).
3. Включить тумблером 2 микрокомпрессор (насос), накачивающий воздух в баллон и выждать, пока разность уровней жидкостей в коленах манометра не составит 15-20см. Выключить компрессор и выждать 1-2 минуты, пока положение уровней жидкости в манометре перестанет изменяться. (При накачивании воздух, сжимаемый под поршнем насоса, нагревается. Вследствие теплообмена с окружающей средой с течением времени происходит понижение температуры воздуха в баллоне и, вместе с этим, понижение уровней жидкости). Измерить h1 (разность высот жидкости в коленах манометра).
4. После замера высоты h1 повернуть красное колесико на ¼ оборота по часовой стрелке (не до конца). При этом баллон соединяется с атмосферой и уровни жидкости в коленах манометра выравниваются.
5. После выравнивания уровней жидкости красное колесико повернуть по часовой стрелке до щелчка (до конца). При этом баллон перекрывается от атмосферного воздействия. Выждать 1-2 минуты, пока положение уровней жидкости в манометре перестанет изменяться (охлажденный при адиабатическом расширении воздух в баллоне будет нагреваться до комнатной температуры, что вновь приведет к изменению уровней жидкости в манометре), измерить разность высот жидкости в коленах манометра h2.
6. Повторить пятикратно измерения разности высот h1 и h2. Результаты измерений записать в табл.
7. Вычислить показатель адиабаты по формуле (4) для каждого случая.

8. Рассчитать среднюю величину показателя адиабаты и абсолютную ошибку измерений. Результаты расчетов занести в табл.
Таблица
| I | h1 | h2 | 
| |
 = =
|  = =
|
9. Представить результаты измерений в виде 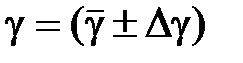 и сделать выводы.
и сделать выводы.
Контрольные вопросы
1. Какой газ называют идеальным? При каких условиях формулы, полученные для него, можно использовать для расчета характеристик реального газа?
2. Запишите уравнение состояния идеального газа. Получите из него уравнения изопроцессов. Нарисуйте PV-диаграммы этих процессов.
3. Сформулируйте первое начало термодинамики.
4. Что такое удельная и молярная теплоемкости? Как они взаимосвязаны?
5. Что такое число степеней свободы? Как подсчитать его для одноатомной и многоатомной молекулы газа?
6. Напишите формулы для расчета теплоемкости идеального газа при постоянном объеме и постоянном давлении.
7. Напишите соотношение Р.Майера для удельных теплоемкостей. Объясните физический смысл постоянной R и укажите её размерность.
8. Дайте определение адиабатического процесса. Напишите уравнение Пуассона для него.
9. Что такое показатель адиабаты? Напишите формулу для его расчета через число степеней свободы молекулы.