 |
|
Матеріали візуального супроводу
БІОХІМІЯ
Розділ „Динамічна біохімія”
спеціальність 5.05170101 „Виробництво харчової продукції”

Миколаїв-2012
Лекція №1. Загальні уявлення про обмін речовин і енергії
Основні питання:
1. Сутність процесу обміну речовин. Одиниці вимірювання енергетичного обміну. Дихальний коефіцієнт.
2. Стадії катаболізму біомолекул.
„Життя – є спосіб існування білкових тіл, істотним моментом якого є постійний обмін речовин із зовнішньою природою, що їх оточує, причому з припиненням цього обміну речовин припиняється життя....”
Ф.Енгельс
Обмін речовин (метаболізм) – сукупність біохімічних реакцій перетворення хімічних сполук (метаболітів), що відбуваються в живих організмах.
Суттєві ознаки обміну речовин у живих організмах:
ü Скоординованість біохімічних перетворень у просторі і часі, завдяки чому різні процеси здійснюються одночасно, не заважаючи один одному. Забезпечення: окремі біохімічні перетворення відбуваються на певних ділянках клітин чи в специфічних органелах клітин.
ü Перебіг процесів відбувається у суворо визначеній послідовності, при цьому кожна попередня реакція створює умови для здійснення наступної. Забезпечення: ферменти, які забезпечують складні біохімічні перетворення численних субстратів та спряженість цих перетворень на метаболічному та енергетичному рівнях.
 |

Обмін речовин складається:
a Фізіологічні процеси (травлення, всмоктування, виділення);
a Фізичні процеси (сорбція, дифузія, осмос);
a Хімічні процеси (окислення, відновлення, гідроліз, фосфороліз).
Ці процеси здійснюються при проміжному та внутрішньоклітинному обміні.
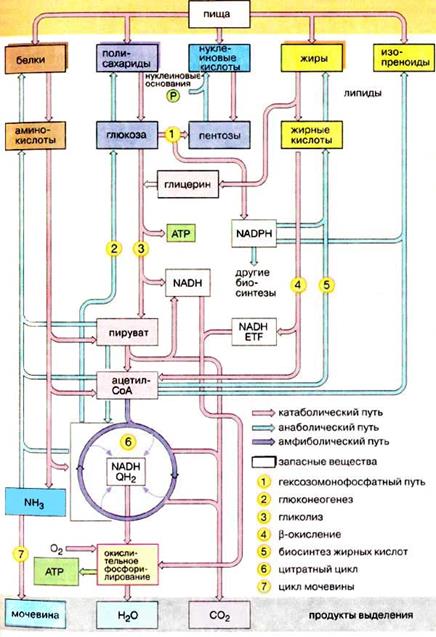
Катаболізм ‑ сукупність процесів розщеплення біомолекул з вивільненням енергії.
| Реакції внутрішньоклітинного метаболізму | Розщеплення біоорганічних молекул (глюкози, жирних кислот, амінокислот, гліцерину) до кінцевих продуктів проміжного обміну (оксиду вуглецю, води, аміаку) з вивільненням хімічної енергії та акумуляцією її у формі АТФ, інших макроергічних фосфатів або протонного потенціалу, що забезпечує енергетичні потреби основних процесів життєдіяльності ‑ катаболізм. |
| Синтез специфічних, генетично притаманних даному організму біомолекул білків, нуклеїнових кислот, полісахаридів, ліпідів, біорегуляторів), що необхідні для утворення власних клітинних та позаклітинних біоструктур – анаболізм. | |
| Використання енергії (у формі АТФ або протонного потенціалу) для забезпечення функціонування скоротливих структур (м’язове скорочення, діяльність елементів цитоскелету), активний транспорт метаболітів та неорганічних іонів. |
Процеси перетворення одних метаболітів на інші, що каталізуються ферментами, складають метаболічні шляхи.
 |
| Класифікація метаболічних шляхів: | Ø Катаболічні шляхи, які становлять в сукупності катаболізм(катаболічні реакції) – реакції розщеплення (гідролізу, окислення) біоорганічних речовин, що надходять із зовнішнього середовища у складі продуктів харчування та біомолекул, які складають структуру клітин та тканин організму. |
| Ø Анаболічні шляхи, які становлять анаболізм (анаболічні реакції) – реакції синтезу складних біоорганічних сполук, що складають різні структурні утворення організму (білків, нуклеїнових кислот, полісахаридів)та забезпечують його функціонування (ліпідів, моносахаридів, амінокислот, нуклеотидів, вітамінів, коферментів, гормонів). | |
| Ø Амфіболічні шляхи, які містяться на перехрестях катаболізму та анаболізму; метаболіти, що складають амфіболічні шляхи, можуть перетворюватися як в катаболічних, так і в анаболічних процесах (цикл трикарбонових кислот). |
 |  |

a Асиміляція– процес засвоєння організмом органічних і неорганічних речовин, які він перетворює на складові частини своїх клітин і тканин. Забезпечує процеси росту, розвитку, самооновлення організму. Супроводжується анаболічними реакціями, з використанням енергії (ендергонічні).
a Дисиміляція– розпад харчових продуктів, які надходять в організм, руйнування речовин, що входять до складу клітин і тканин. Характерні катаболічні реакції: гідроліз, фосфороліз та окислення, які супроводжуються виділенням енергії (екзергонічні).
Висновок:
a Сукупність тісно пов’язаних між собою процесів асиміляції і дисиміляції є обміном речовин – характерною особливістю всіх без винятку живих істот.
a Процеси асиміляції та дисиміляції в організмі відбуваються одночасно.
a Анаболічні реакції (реакції синтезу), що характерні для асиміляції, забезпечують утворення органічних сполук, необхідних для побудови структур організму.
a Катаболічні реакції (реакції розкладу), які характерні для дисиміляції забезпечують виділення енергії, необхідної для синтезу складних органічних сполук та утворення кінцевих продуктів обміну.
Співвідношення між процесами асиміляції і дисиміляції:
1. Переважання процесів асиміляції над процесами дисиміляції характерно для періоду росту та розвитку організму.
2. Переважання процесів дисиміляції над процесами асиміляції характерно для паталогічних процесів та старінні організму.
3. За нормальних фізіологічних умов в організмі забезпечується стабільна рівновага даних процесів.
Обмін речовин в організмі тісно пов’язаний з обміном енергії. Постійне надходження та використання енергії є необхідною умовою існування живих організмів як відкритих систем.
Шляхи використання енергії організмом:
1 Виконання різної роботи, руху, скорочення та розслаблення м’язів;
1 Синтез та розщеплення різних сполук, транспорт речовин і іонів;
1 Підтримання гомеостазу;
1 Виконання специфічних функцій, що забезпечують процеси життєдіяльності.
Обмін енергії включає такі процеси, як виділення, перетворення, акумулювання та використання енергії організмом, тобто обмін речовин в організмі супроводжується постійним обміном енергії завдяки тісному взаємозв’язку анаболічних та катаболічних реакцій.
Вивільнення енергії здійснюється поступово і включає три основні стадії (стадії катаболізму біомолекул):
1. Підготовча– перетравлювання та всмоктування поживних речовин, вивільняється менше 1% енергії.
2. Анаеробне окислення продуктів гідролітичного розщеплення біополімерів (амінокислот, моносахаридів, жирних кислот) до метаболітів (ацетил-КоА, щавлевооцтова кислота), вивільняється близько 1/3 енергії, що акумульована в хімічних зв’язках органічних сполук.
3. Аеробне окислення до кінцевих продуктів, здійснюється в циклі Кребса, вивільняється 2/3 енергії. Нагромаджуються відновні еквіваленти у вигляді НАД∙Н2; НАДФ∙Н2; ФАД∙Н2, які є генераторами енергії і забезпечують синтез АТФ у процесі тканинного дихання.
Висновок:
В організмі існує тісний взаємозв’язок між процесами вивільнення та використання енергії. Основна маса енергії акумульованої в хімічних зв’язках органічних сполук, вивільняється при анаеробному та аеробному окисленні. Виділена енергія не використовується безпосередньо для потреб організму, а попередньо перетворюється на доступну форму – АТФ, яка виступає в ролі донора, акцептора та трансформатора енергії.
Енергія , що вивільняється при окисленні органічних сполук, акумулюється в макроергічних зв’язках, з яких вона разом з активними фосфорильними групами передається на АДФ, внаслідок чого синтезується АТФ.
Макроергічні зв’язки – це зв’язки, при перетворенні яких рівень зміни енергії становить понад 20кДж/моль, позначаються ~.
Макроергічні сполукимістять фосфатну групу в α-положенні, яка при розриві макроергічного зв’язку може переноситися на інші сполуки у вигляді радикалу – активного фосфорилу.
Органічні сполуки ®(окислення)®макроергічні сполуки ®(фосфорилювання)® АТФ

| 
| |
| Проміжний метаболізм |
Лекція 2. Ферменти
Основні питання:
1. Хімічна природа ферментів. Номенклатура та класифікація ферментів.
2. Механізм дії ферментів.
3. Активність ферментів, вплив на неї різних факторів.
4. Використання ферментів. Ферментативний аналіз.
Ферменти‑ біологічні каталізатори білкової природи, які утворюються будь-якою живою клітиною та здатні активізувати різноманітні хімічні сполуки. На сьогодні відомо близько 2тис. ферментів.
Ферменти беруть участь також у регуляції багатьох метаболічних процесів, забезпечуючи тим самим відповідність обміну речовин зміненим умовам. Більшість ферментів ‑ білки.
За хімічною будовою ферменти класифікують на:
| · Однокомпонентні ферменти, ферменти-протеїни (прості ферменти): складаються тільки з поліпептидних ланцюгів, при гідролізі розщеплюються до амінокислот, каталізують процеси гідролізу. Належать ферменти, які складаються тільки з каталітично активного білка. Роль активних груп виконують певні хімічні групування, що входять до складу білка (каталітичні центри, активні центри). Приклади: пепсин, трипсин, рибонуклеаза, уреаза, естераза печінки. | 
| 
|
| · Двокомпонентні ферменти, ферменти-протеїди (складні ферменти): складаються з білкової частини (апофермент)і небілкового компоненту – кофактор. | Лізоцим курячого яйця (простий фермент) | Молекула лактатдегідрогенази (ЛДГ) |
Апофермент зумовлює специфічність взаємодії між ферментом і субстратом.
Кофактор підвищує стійкість білкової частини, може каталізувати інші процеси.
Якщо небілковий компонент тісно пов’язаний з білком і відокремлюється тільки при дії денатуруючих факторів – простетична група.
Якщо група небілкової природи (кофактор) сполучена з білковою частиною ферменту слабкими електростатичними або Ван-дер-ваальсівськми силами, то вона називається кофермент. Основними коферментами є НАД+, ФАД, КоА.
Каталітичну дію окремо не виявляють ні апофермент, ні кофермент. Каталітичну дію демонструє тільки комплекс (холофермент) – молекула ферменту.

| Нуклеотидний кофермент аденозинтрифосфат [АТФ (АТР)] є найбільш важливою формою збереження хімічної енергії в клітинах. Розщеплення АТФ — високо екзергонічна реакція. Хімічна енергія гідролізу АТФ може використовуватися для спряження з ендергонічними процесами, такими, як біосинтез, рух і транспорт. А. АТФ: структура В АТФ ланцюг з трьох фосфатних залишків сполучений з 5'-OH-групою аденозину. Фосфатні групи позначаються як α, β и γ. Рибоза сполучена з α-фосфатом фосфоефірним зв’язком. Три фосфатні залишки сполучені між собою менш стійкими фосфоангідридними зв’язками. Діючим коферментом є комплекс АТФ з іоном Mg2+, координаційно зв’язаним з α- та β-фосфатом. Для простоти говорять тільки про АТФ. Б. Фосфоангідридні зв’язки Причиною відносної нестабільності фосфоангідридних зв’язків є сильне відштовхування негативно заряджених атомів кисню, яке послаблюється при гідролітичному відщепленні кінцевої фосфатної групи. Тому такі реакції є високо екзергонічними. При гідролізі АТФ утворюється вільний фосфат-аніон, який краще гідратований і більш ефективно стабілізований, ніж відповідний залишок в АТФ, що сприяє гідролізу АТФ. | |
| За характером своєї каталітичної дії ферменти поділяють на шість класів: 1. оксидоредуктази або окислювально-відновлювальні ферменти; 2. трансферази, тобто ферменти, що каталізують перенесення різних груп атомів з однієї молекули на іншу. Для дії оксидорекдуктаз і трансфераз обов’язкова наявність спільного коферменту. 3. гідролази, які каталізують гідролітичні реакції; беруть участь у переносі груп, проте акцептором є молекула води. 4. ліази ‑ ферменти, які відщеплюють від субстратів ту чи іншу групу (не шляхом гідролізу) з утворенням подвійного зв’язку, або навпаки, приєднують за подвійними зв’язками; 5. ізомерази, тобто ферменти, що каталізують реакції ізомеризації органічних сполук; 6. лігази або синтетази – до цього класу належать ферменти, що каталізують реакції синтезу (енергозалежні реакції), їх дія пов’язана з гідролізом АТФ. | 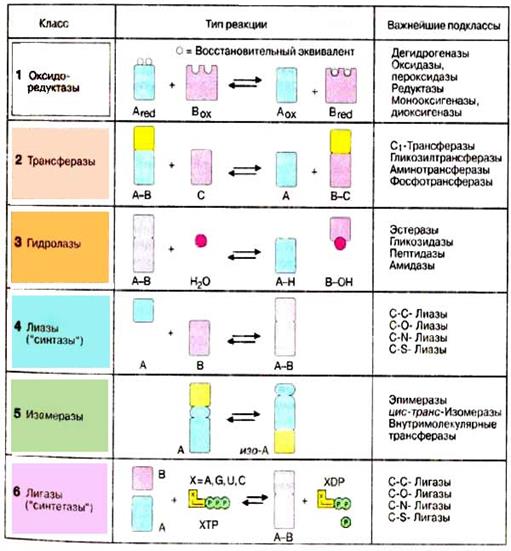
| |
Розроблена система класифікації враховує реакційну та субстратну специфічності ферментів. Всі ферменти вміщені в «Каталог ферментів» під своїм класифікаційним номером(КФ), який складається з чотирьох цифр. Перша цифра вказує на приналежність до одного з шести головних класів. Наступні дві цифри визначають підклас і підпідклас, а остання цифра — номер ферменту в даному підпідкласі. Наприклад, лактатдегідрогеназа має номер КФ 1.1.1.27 (клас 1, оксидоредуктази; підклас 1.1, донор електрона — СН-ОН; підпідклас 1.1.1, акцептор — НАДФ+).
 | |||
 | |||
| 
|
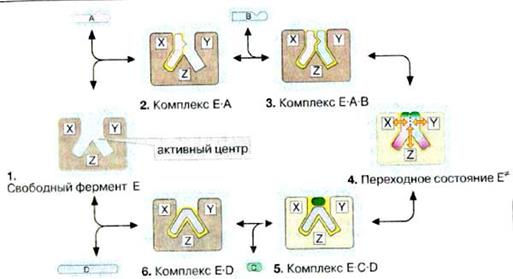
Ферментативна реакція. Ферментативний каталіз.
Висновки:
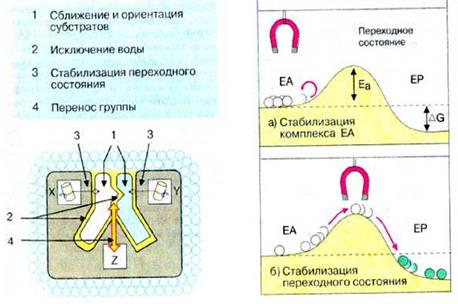
þ Механізм дії ферментів – утворення фермент-субстратних комплексів; обумовлений зниженням енергії активації, що необхідна для перебігу хімічної реакції, спрямовуючи її крізь проміжні реакції, які вимагають значно меншої енергії активації.
þ Природа каталітичної дії ферментів пояснюється теорією проміжних сполук і адсорбційною теорією.
І етап. Субстрат з’єднується з ферментом за рахунок слабких сил.
ІІ етап. Відбувається активація і видозмінення субстрату з утворенням одного або кількох активованих комплексів, супроводжується розривом і утворенням ковалентних зв’язків.
ІІІ етап. Відокремлення продуктів реакції від ферменту, який змінює молекулу субстрату так, що міцність окремих хімічних зв’язків зменшується, що призводить до зниження енергії активації.
þ Багато ферментів під час каталізу переносять специфічні групування з субстрату або на субстрат. Особливо часто здійснюється перенесення протонів. Такий ферментативнийкислотно-основний каталізє більш ефективним, ніж обмін ферменту.
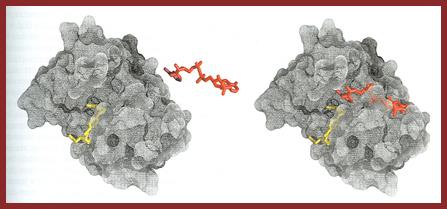
þ Зв’язування ферменту з субстратом здійснюється через активний центр, який розміщений на поверхні глобул.
Активний центр ферменту складається з функціональних груп, які відповідно зорієнтовані у просторі.

| Загальна схема ферментативного каталізу: Е + S → ЕS → ЕS*→Е+П, Е – фермент; S – субстрат; ЕS – первинний фермент – субстратний комплекс; ЕS* ‑ активований комплекс; П – продукт реакції. |
 | |||
 |
| 
| |
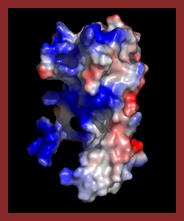
| Складна поверхня білка забезпечує специфічність його взаємодії з іншими молекулами | Складна поверхня білка і розподіл заряду |
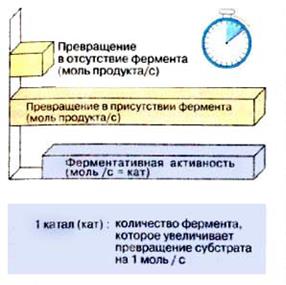 Активність ферменту
Активність ферменту

| Особливі властивості ферментів: 8 Висока каталітична активність (амілаза за 1хв. перетворює 1100000 молекул субстрату). Каталітична дія ферменту (ферментативна активність) визначається за стандартних умов за збільшенням швидкості (фіолетовий колір на схемі) каталітичної реакції порівняно з некаталітичною реакцією. Швидкість реакції визначають за зміною концентрації субстрату або продукту за одиницю часу (моль/(л·с)). Каталітична активність не залежить від об’єму розчину, в якому відбувається реакція. Каталітична активність ферментів виражається у каталах, млкаталах, мккаталах. Катал– це каталітична активність ферменту, який здійснює хімічне перетворення 1 моль субстрату за 1с. Іншою одиницею активності є міжнародна одиниця(E) — кількість ферменту, що перетворює 1 мкмоль субстрату за 1 хвилину (1 E = 16,7 нкат). На активність ферментів впливають: температура, значення рН середовища, активатори та інгібітори. 8 Чутливість до температури (термочутливі та термолабільні). При підвищенні температури каталітична активність ферментів збільшується, але до певної межі. При t>800С – денатурація білкового компонента, втрата активності ферментів. При низьких температурах – дія ферментів припиняється (не руйнуються). |
Оптимальна активність ферментів спостерігається при t = 37 – 400С (збільшення швидкості ферментативної реакції). Якщо при захворюванні температура тіла людини підвищилась до 39,5 С, то це свідчить про прискорення біохімічних процесів у 1,13 – 1,39 рази (13-19%). Підвищення температури до 40 ‑ 420С призводить до швидкого зниження біохімічного процесу у зв’язку з денатурацією та інактивацією ферментів. Дія ферментів тваринного походження оптимальна при t = 40 – 50 С; для ферментів рослинного походження t = 50 – 60 С.

| 8 Специфічність дії ферментів, зумовлена конформаційною та електростатичною компліментарністю між молекулами ферменту; субстрату і структурою активного центру ферменту. Суттєва особливість каталітичної дії ферментів полягає у специфічності, тобто дія ферменту направлена на строго визначені хімічні зв’язки. Специфічність: ü абсолютна (каталізують лише одну реакцію) – фермент уреаза каталізує гідролітичне розщеплення сечовини на СО2 і NH3; ü абсолютна групова (каталізують певний тип реакції) – пепсин, трипсин, хімотрипсин каталізують розщеплення пептидних зв’язків у білках і пептидах; ü відносна групова (каталізують розщеплення окремого типу хімічного зв’язку) – фермент ліпаза гідролізує складно ефірний зв’язок в жирах; ü стереоізомерна, просторова. a Чутливість до рН середовища (зумовлена іонізацією активного центру, субстрату і кофакторів, що впливає на формування активного фермент ‑ субстратного комплексу). Кожний фермент має свій рН-оптимум, тобто значення рН середовища, при якому його каталітична активність максимальна. Оптимальні значення рН для: þ пепсину 1,5–2,5; þ трипсину 7,5-8,5; þ хімозину 6,0; þ кишкової мальтази 5,8-6,1; þ амілази слини 6,8-7,0; þ панкреатичної ліпази 7,0-8,5. |
| Поняття специфічності належить до типів каталітичних реакцій (реакційна специфічність), до природи сполук ‑ субстратів (субстратна специфічність). На схемі наведені ферменти, які розщеплюють хімічний зв’язок. Ä Високоспецифічні ферменти типу А каталізують розщеплення тільки одного типу зв’язку в субстратах певної структури. Ä Ферменти типу Б виявляють обмежену реакційну специфічність, проте широку субстратну специфічність. Ä Ферменти типу В з низькою реакційною та низькою субстратною специфічностями зустрічаються рідко. |