 |
|
Промисловість реактивів і особливо чистих речовин. 8 страница
Для збагачення, яке проводиться тертям з поверхнею, застосовують спіральні (гвинтові) сепаратори.
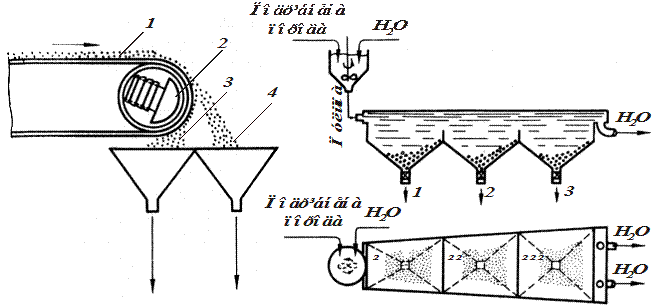
В основу електромагнітного збагачення покладено різну магнітну сприйнятливість мінералів, які входять до складу сировини. Частинки мінералу, що намагнічуються при проходженні через магнітне поле, відхиляються від свого попереднього шляху (рис. 8.3) і падають окремо від частинок, які не зазнають впливу магнітного поля.
Електростатичні сепаратори служать для розділення матеріалів, які мають різну електропровідність. Принцип їхньої конструкції подібний до електромагнітного сепаратора, але замість магніту встановлено електрод, сполучений з негативним полюсом випрямляча електричного струму. Частинки мінералів, які мають високу електропровідність, заряджаються негативно і відштовхуються у віддалений бункер, а діелектрики падають у бункер, розміщений під стрічкою транспортера. Так можна відділяти електропровідні мінерали від діелектричних порід: вапняків, силікатів, гіпсу.
| |
| Рис. 8.3. Схема дії електромагнітного сепаратора: 1 – вихідна руда; 2 – електромагніт; 3 – концентрат; 4 – відвал | Рис. 8.4. Схема мокрого гравітаційного збагачення: І, II, III – осаджувальні камери; 1 – важка (крупнозерниста) фракція; 2 – середня фракція; 3 – легка (дрібнозерниста) фракція |
Гравітаційне або гідравлічне збагачення(мокре чи сухе) ґрунтується на різній швидкості осадження у рідині або газовому потоці зерен різних розмірів або різної густини.
Мокре збагачення найчастіше здійснюють у потоці води. В іншому випадку застосовують інертну рідину або сухе збагачення. Для сухого збагачення треба брати більш подрібнений матеріал сильніше, ніж для мокрого. Принципова схема мокрого гравітаційного збагачення наведена на рис. 8.4. Подрібнений і змішаний з водою матеріал (пульпа) подається у відстійник, розділений перегородками на три осаджувальні камери. Великі і важкі часточки осідають у камері І, середні – у камері II і найлегші – у камері III. Залежно від кількості осаджувальних камер можна добути будь-яку кількість фракцій. Осадження легких фракцій здійснюється внаслідок зменшення швидкості потоку та розширення відстійника.
Дуже ефективними є відцентрові гідравлічні класифікатори, робота яких ґрунтується на дії відцентрових сил.
Крім наведених методів збагачення застосовуються ще термічне збагачення, яке ґрунтується на різній плавкості мінералів, що входять до складу суміші.
Хімічні способи збагачення ґрунтуються на застосуванні різних реагентів, які вибірково розчиняють або утворюють сполуку з однією з речовин суміші; розчини збагачуються випаровуванням розчинника, донасиченням корисним компонентом, осадженням одного з комлонентів, або переведенням його у газоподібний стан і т.ін. Наприклад, Au і Ag можна вилучити за допомогою Hg, NaCN і KCN, мідь – H2SO4 або NH3 і т. д.
Збагачення методом екстракції деякихкомпонентів суміші рідин широко застосовується у технології органічних речовин; газові суміші збагачуються або розділяються на окремі компоненти послідовною конденсацією газів, послідовною ректифікацією з попередньо-зрідженої суміші газів, абсорбційно-десорбційним і адсорбційно-десорбційним методами.
8.3. Сировина рослинного і тваринного походження
Успіхи органічної хімії і взагалі науки дають змогу добувати різні цінні продукти з найрізноманітнішої сировини. Так, етанол, величезні кількості якого використовують в органічному синтезі, можна добувати з харчових продуктів – зерна, картоплі та цукрового буряка, гідролізом деревини і гідратацією етилену. Етилен, у свою чергу, добувають хімічною переробкою природних газів, нафти та інших видів палива. З продуктів переробки нафти і газів добувають також оцтову кислоту, гліцерин і жири для виробництва миючих засобів. При цьому заощаджується багато харчової сировини для інших потреб, досягається велика економія і здешевлюється продукція. Сировина рослинного і тваринного походження вже замінена у багатьох виробництвах і заміна її успішно триває далі.
Сировина рослинного і тваринного походження має ряд характерних властивостей, залежно від яких вибираються способи її зберігання і переробки. Деякі операції попередньої підготовки сировини проводять також для підвищення в її складі корисних складових частин та видалення домішок і відходів. Відходи багатьох сільськогосподарських культур містять дуже цінні речовини, потрібні у народному господарстві і особливо у медицині. Особливістю сировини рослинного і тваринного походження є те, що вона легко псується, склад її і якість швидко змінюються, тому при зберіганні її слід застосовувати ряд специфічних запобіжних заходів: консервування, сушіння, стерилізацію, зберігання в атмосфері СО2 або інертних газів, у водо- і повітронепроникній плівці.
Середня проба, склад і якість сировини.Велике значення для хімічної технології має дослідження складу і якості сировини, для чого треба правильно відібрати її середню пробу. Пробу з родовища або на підприємстві відбирають за суворо визначеною системою, яка відповідає ДСТ або ТУ: площу залягання сировини поділяють вертикально і горизонтально на невеликі ділянки і з кожної окремо беруть зразки. Усі зразки, змішані разом, вважаються середньою пробою. Часто середню пробу відбирають з допомогою бурового свердла. Ці стовпчики відібраної проби поділяють на дві рівні частини, одна з яких іде на аналіз, а друга зберігається для контролю.
Для "виготовлення" середньої проби відбирають зразки з якомога більшої площі і більшого числа місць, у більшій кількості, ніж це потрібно для аналізу. Потім з усієї маси матеріалу відбирають нову, меншу пробу і т. д. Операція зменшення середньої проби називається скороченням проби. При цьому всю відібрану масу дуже старанно перемішують, добре подрібнюють і розмелюють, а потім ще розтирають. З цієї маси відбирають ще меншу пробу, з якої у лабораторії потрібну для хімічного аналізу середню пробу відбирають способом квартування. Для цього добре розтерту масу розподіляють шпателем тонким, рівномірним шаром на аркуші паперу і поділяють вздовж і впоперек на 12-16 невеликих квадратів. З кожного квадрата відбирають приблизно однакову кількість на другий аркуш паперу і повторюють так кілька разів, поки проба зменшиться до десятків грамів, з яких беруть наважки для хімічного аналізу. У заводських лабораторіях здебільшого роблять тільки хімічні і механічні аналізи. Якщо технологія виробництва потребує більш докладного аналізу, то проводяться ще мікроскопічні, термічні, електротермічні, рентгеноструктурні та інші дослідження.
8.4. Енергія у хімічному виробництві
В хімічній промисловості енергія витрачається не тільки для проведення хімічної реакції того чи іншого технологічного процесу, а й на різні допоміжні роботи, пов'язані з виробництвом. Витрата енергії визначається кількістю кіловат-годин, кілокалорій (кілоджоулів) або кількістю палива (тонн, кілограмів, кубометрів), витрачених на виробництво одиниці продукції. В енергетичному відношенні виробничі процеси поділяються на силові, теплові, електрохімічні, електротермічні та ін. Для здійснення цих процесів застосовується енергія електричного струму, водяної пари, гарячої води, палива, радіоактивного випромінювання, сонячна енергія.
Провідна роль у сучасній промисловості належить електричній енергії: її найлегше передавати на далекі відстані і використовувати у виробництві для різноманітних потреб. Здійснення деяких виробничих процесів стало можливим тільки завдяки застосуванню електричної енергії. Це – електрохімічні, електротермічні, електромагнітні процеси, а також процеси, пов'язані з використанням електростатичних явищ. Дуже широко використовується перетворення електричної енергії у механічну, яка потрібна для проведення операцій подрібнення, змішування, центрифугування, транспортування рідин і газів, роботи компресорів, вентиляторів та ін.
Електричні печі є основою розвитку високоякісної металургії. На базі електротермії створено і розвиваються виробництва феросплавів, спеціальних сплавів, чистих і надчистих кольорових, рідкісних і легких металів, кальцію карбіду, фосфору.
Джерелами електроенергії є використання енергії води на гідроелектростанціях, а також перетворення теплової й атомної енергії в електричну на теплових і атомних електростанціях.
Теплова енергія широко використовується у хімічній промисловості для здійснення багатьох фізичних операцій: нагрівання, плавлення, сушіння, випарювання, дистиляції, а також для проведення ендотермічних процесів. Джерелом теплової енергії є паливо, при спалюванні якого утворюються паливні гази, їх використовують безпосередньо або для добування водяної пари, гарячої і перегрітої води та ін. Крім палива, для отримання теплової енергії використовується перетворення електроенергії у теплову.
Оскільки температура є одним з основних чинників зміни швидкості хімічних реакцій, створення оптимального теплового режиму відіграє у хімічній технології надзвичайно важливу роль. Теплова енергія екзотермічних реакцій становить незначну частку порівняно з іншими видами енергії, що використовуються у хімічній технології.
Ядерна енергія. Освоєння і промислове застосування ядерної енергії для виробництва електричної енергії безмежно збільшує запаси природної енергії. Дедалі більшого поширення набувають радіаційні хімічні процеси. Подальше використання атомної енергії у хімічній технології є актуальним завданням сучасної науки і техніки.
Хімічна енергія гальванічних елементів і акумуляторів поки що мало використовується у хімічній технології. У майбутньому ці джерела енергії матимуть величезне значення, тому що при невеликих габаритах у них можна досягати великої потужності з високим к. к. д. Останнім часом для збільшення строку використання у гальванічний елемент добавляють активний матеріал у міру його витрати. Це досягається у спеціальних приладах – електрохімічних генераторах електричної енергії. Прилади, в яких активним матеріалом негативного електрода є звичайне паливо – природний газ, Н2, CO тощо – називають паливними елементами. Активним матеріалом катода може бути О2.
Останнім часом широко використовують хімічну енергію вибухових речовин убудівництві гідроелектростанцій, шляхів, каналів, добуванні сировини з родовищ та ін. Хімічна енергія нагромаджується і витрачається також і у біохімічних процесах, які відбуваються у рослинних клітинах. Біохімічні процеси лежать в основі багатьох важливих виробництв, таких як дріжджове, хлібопекарське, спиртове, пивоварне, виробництво чаю, тютюну, ацетону, оцтової, лимонної, молочної та олійної кислот.
Світлову енергію дедалі частіше використовують у хімічній технології для проведення фотохімічних процесів: синтезу хлороводню, галогенування і сульфування органічних сполук. Світлова енергія перетворюється в електричну у фотоелементах, які широко використовуються у промисловості для автоматизації і механізації технологічних процесів, контролю виробництва, для сигналізації і регулювання технологічних процесів, при збагаченні сировини та ін.
На хімічних підприємствах велике значення має вторинна енергія у вигляді відходів або побічних продуктів виробництва – гарячих газів, води, рідин, пари тощо, які широко використовуються для здійснення технологічних процесів і для побутових потреб.
Промислові ресурси енергії закладені у запасах вугілля, нафти, природних газів, торфу, сланців, деревини, гідроенергії, частково енергії вітру і сонячної енергії. Світові запаси основних видів палива становлять приблизно 6000 млрд. т умовного палива, з якого 91,8 % припадає на кам'яне вугілля і лігніни, 3,1 % – на нафту і 1,9 % – на природні гази. У світових запасах урану і торію міститься енергія, яка у десятки разів перевищує потенціальну енергію відомих запасів вугілля, нафти і природних газів разом взятих. Та хоч які великі запаси енергетичних ресурсів у нашій країні, треба на кожному кроці запроваджувати сувору економію енергії і раціональне використання її на виробництві. Боротьба з усіма видами понаднормових витрат енергії і нераціонального її використання є важливим завданням хімічної технології.
У майбутньому, можливо, набудуть великого значення такі джерела енергії, як енергія вітру, сонця, теплоти земної кори, припливів і відпливів.
Раціональне використання енергії.В енергомістких хімічних виробництвах витрати енергії впливають на техніко-економічні показники процесів. Критерієм економічного використання її є "коефіцієнт використання енергії". Коефіцієнтом, використання енергії hE називається відношення кількості енергії, яку необхідно витратити теоретично на добування одиниці (маси або об'єму) продукції Wm до кількості практично витраченої енергії Wпp:
 .
.
Ступінь використання теплоти у хіміко-технологічному процесі виражається тепловим к. к. д. hТ, під яким розуміють відношення кількості теплоти, використаної на здійснення основних хімічних реакцій Qт, до загальної кількості теплоти, витраченої на процес Qnp.
 .
.

Рис. 8.5. Котел-утилізатор: 1 – вентиль; 2 – вологовіддільник; 3 – корпус; 4 – труби, через які проходять гарячі гази; 5 – штуцер для введення води
Щоб визначити тепловий к. к. д. апарата, треба скласти тепловий баланс. Для використання теплотигазоподібними продуктами реакцій у спеціальних теплообмінниках – рекуператорахнагрівають реагенти, що надходять в апарат. Теплоту газоподібних продуктів використовують також в апаратах-регенераторахенергії для нагрівання газів-теплоносіїв або для виробництва пари у котлах-утилізаторах,схема якого наведена на рис. 8.5. Гарячі гази рухаються по трубах, розміщених у корпусі апарата; у міжтрубному просторі знаходиться вода, яка подається через штуцер. Водяна пара, що утворюється у котлі, виводиться через вентиль. Теплоту продуктів відходу на хімічних заводах використовують для сушіння, випарювання, дистиляції та нагрівання води для потреб заводу або населення.
Питання до розділу 8
1. Загальна класифікація сировини.
2. Що означає "комплексне використання сировини"?
3. На які групи поділяють мінеральну сировину?
4. Які основні елементи входять до складу земної кори?
5. Що називають збагаченням руди?
6. Що називають виходом концентрату, ступенем вилучення і ступенем збагачення?
7. Які основні операції попередньої обробки сировини?
8. Які способи використовують при збагаченні твердої сировини?
9. На чому ґрунтуються хімічні способи збагачення сировини?
10. Яка різниця між повітряними, електромагнітними і електростатичними сепараторами?
11. На чому ґрунтується гравітаційне збагачення руди?
12. Що таке флотація?
13. Які засоби використовують для підвищення ефективності флотації?
14. Який принцип дії флотаційної машини?
15. Які ще є методи збагачення руд?
16. Які переваги і недоліки сировини рослинного і тваринного походження?
17. Які види енергії використовують у хімічній промисловості?
18. Що таке вторинна енергія? Її використання.
19. Що називають коефіцієнтом використання енергії?
20. Що називають ступенем використання теплоти у хіміко-технологічному процесі?

Частина II. ПРОМИСЛОВІ ХІМІЧНІ ВИРОБНИЦТВА
Розділ 9. ВИРОБНИЦТВО АМОНІАКУ
9.1. Зв'язаний азот та його значення
Азот відіграє винятково важливу роль у природі загалом і у житті людини зокрема. Він входить до складу всіх живих організмів і бере участь в основних біохімічних процесах. У складі білків азот утворює найважливіші поживні речовини для тварин і людини. Дуже велике значення має азот у життєдіяльності рослинного і тваринного світу. Сполуки азоту широко використовуються у виробництві проміжних продуктів і барвників, для виготовлення пластичних мас, хімічних волокон, медикаментів, фотокіноматеріалів та ін. Сполуки азоту мають велике значення у виробництві вибухових речовин і запалювальних засобів. У земній корі міститься порівняно велика кількість азоту (0,04 %), який входить до складу кам'яного і бурого вугілля, торфу та інших речовин.
Над одним гектаром землі у повітрі знаходять близько 80 000 т молекулярного азоту, що у мільйон разів більше тієї кількості, яка виноситься з ґрунту врожаєм з 1 га за рік. Проте азот N2 – дуже стійка речовина. У синтезі білків у рослинних і тваринних організмах бере участь не елементарний азот, а зв'язаний, тобто його хімічні сполуки. Доступні для промислового використання поклади азотних сполук (натрієвої селітри) знайдено тільки на узбережжі Чілі та у Південній Африці. Порівняно невелику кількість зв'язаного азоту добувають при коксуванні вугілля. Природні поклади азоту не можуть задовольнити безперервно зростаючі потреби в азотних добривах та інших азотовмісних сполуках.
Атмосферний азот зв'язується у природі різними способами, збагачуючи ґрунт азотними сполуками, однак і це не може перекрити втрати азоту з ґрунту, що виноситься рослинами. Тому великого значення набули мінеральні азотні добрива, які виробляють переважно синтезом NH3 з подальшим перетворенням його в амонійні солі, солі НNО3 та аміди. Крім того, NH3 також застосовують як добриво.
Амоніак – найпростіша сполука азоту з воднем; це безбарвний газ з дуже різким характерним запахом. При –33,4 °С NH3 зріджується і кипить, перетворюючись у прозору рідину, яка твердне при –77,7 °С. Амоніак добре розчиняється у воді, утворюючи розчин, що має лужну реакцію і називається нашатирним спиртом.
Вже у давнину амоній хлорид був відомий під назвою нашатир (від персидської "нушадир" – безсмертний вогонь). У середньовічних алхімічних записах неодноразово згадувалось про появу різкого запаху при дії вапна на NH4C1. У 1774 р. Прістлі вперше добув NH3 за цією реакцією, а у 1785 р. було визначено склад амоніаку.
9.2. Методи зв'язування атмосферного азоту
У першому десятилітті XX ст. було здійснено синтез азотних сполук з азоту трьома методами: дуговим, ціанамідним і амоніачним.
Дуговий методзв'язування атмосферного азоту – це відтворення у промислових умовах процесу, який відбувається у природі під час грозових розрядів. У полум'ї електричної дуги N2 і О2 повітря взаємодіють, утворюючи NO
N2 + О2 = 2NO – 179,2 кДж.
Рівноважні виходи NO з повітря за експериментальними даними дорівнюють:
· температура, °С 1500 1800 2400
· вихід NO, % 0,325 0,72 3,24
З цих даних видно, що NO утворюється тільки при дуже високих температурах і до того ж вихід його невисокий.
Швидкість утворення NO при температурі понад 2000 °С досить велика, рівновага встановлюється майже миттю. Зворотна реакція – дисоціація NO – відбувається з великою швидкістю при температурі понад 1500 °С.
З цього видно, що як з термодинамічного, так і з кінетичного боку умови для технічного здійснення процесу зв'язування атмосферного азоту окисненням його за допомогою електричної дуги важкі і неекономічні.
Внаслідок значних втрат теплоти витрата дорогоцінної у ті часи електричної енергії на промислових установках досягала 60 тис. кВт·год на 1 т зв'язаного азоту. Побудовані свого часу заводи з виробництва HNO3 дуговим способом були закриті.
Зв'язування атмосферного азоту у промислових масштабах з утворенням кальцію ціанаміду почалося наприкінці XIX ст. в Італії. У 1905 р. було налагоджено виробництво CaCN2 за таким рівнянням:
СаС2 + N2 = CaCN2 + С + 301,5 кДж.
Далі CaCN2 взаємодіє з водою, утворюючи NH3.
CaCN2 + 3H2O = CaCO3 + 2NH3.
Досі витрата енергії на зв'язування 1 т азоту ціанамідним способом досить велика і досягає 10‑12 тис. кВт·год. Проте, незважаючи на це, CaCN2 добувають цим способом, оскільки CaCN2 є цінним азотним добривом і вихідним продуктом для добування багатьох неорганічних і органічних азотних сполук.
Амоніачний методзв'язування атмосферного азоту має величезні переваги порівняно з дуговим і ціанамідним способами. Витрата енергії на 1 т зв'язаного азоту у вигляді амоніаку становить 4‑5 тис. кВт·год, враховуючи і паливо для виробництва водню. Економічні переваги методу зв'язування азоту у вигляді NH3 настільки великі, що цей метод за короткий час витіснив усі інші і набув великого поширення.
Тепер основна кількість NH3 йде на виробництво HNO3, твердих і рідких азотних добрив, соди, на синтез багатьох сполук, полімерів, вибухових речовин і т. ін. Амоніак застосовують як холодильний агент і для азотування сталей, для створення інертного середовища та у різних синтезах.
Перший завод синтезу NH3 було збудовано в Німеччині у 1913 р. Поки не виробляли синтетичного NH3, нітратну кислоту та її солі добували з чилійської селітри і NH3, який утворювався під час коксування вугілля. Розвиток азотної промисловості як самостійної великої галузі хімічної промисловості почався тільки з розвитком синтезу NH3.
Здійснення синтезу NH3 стало можливим тільки на основі глибокого вивчення теорії процесу. Саме тоді вперше в історії хімічної промисловості для створення нового технологічного процесу всебічно було використано фізичну хімію. У свою чергу, вивчення процесу синтезу NH3 значно вплинуло на розвиток важливих розділів фізичної хімії: термодинаміки і кінетики каталітичних процесів.
Нові ідеї у технології, пов'язані із створенням виробництва NH3, відіграли велику роль розвитку хімічної промисловості. Синтез метанолу, гідрування вугілля для добування рідкого палива, синтез карбаміду та багато інших процесів значною мірою ґрунтуються на принципах, встановлених при розробці методів синтезу NH3.
Тепер виробництво синтетичного NH3 становить кілька мільйонів тонн на рік. Перші установки для синтезу NH3 мали потужність 20 тис. т NH3 на рік.
У 1958 р. вперше у нашій країні NH3 почали виробляти з водню, отриманого з природного газу, що заощадило сировинні матеріали, знизило собівартість NH3 і значно поліпшило умови праці.
9.3. Отримання та очищення азотоводневої суміші
Азотдля приготування азотоводневої суміші отримують методом зрідження повітря з подальшою ректифікацією. При атмосферному тиску азот кипить при –196 °С, кисень – при –183 °С. Різниця 13 °С достатня для того, щоб зріджене повітря розділити на технічно чисті азот і кисень.
Воденьдля синтезу амоніаку можна отримати такими способами: конверсією метану з водяною парою; конверсією оксиду вуглецю (ІІ) з водяною парою; крекінгом метану; електролізом води; розділенням коксового газу. Основне значення мають методи конверсії метану та оксиду вуглецю, а також розділення коксового газу.
Отримані одним із вказаних способів гази – азот і водень – змішують у відповідному співвідношенні і подають на синтез амоніаку. Однак найчастіше процес синтезу ведуть не з азоту і водню, отриманих окремо, а з азотоводневої суміші, яку готують конверсією метану та оксиду вуглецю з водяною парою і киснем повітря:
СН4 + Н2О  СО + 3Н2 – 206 кДж,
СО + 3Н2 – 206 кДж,
СН4 + 0,5O2  CO + 2Н2 + 35 кДж.
CO + 2Н2 + 35 кДж.
Вторинна реакція конверсії оксиду вуглецю з водяною парою відбувається за рівнянням:
CO + Н2О  СO2 + Н2 – 41 кДж.
СO2 + Н2 – 41 кДж.
Сумарно конверсія метану з водяною парою відбувається з поглинанням теплоти:
СН4 + 2Н2О  СО2 + 4Н2 – 165 кДж.
СО2 + 4Н2 – 165 кДж.
Каталізатори конверсії метану, конверсії оксиду вуглецю і синтезу амоніаку отруюються деякими домішками, які наявні у газовій суміші. Особливо сильною отрутою для каталізаторів є сірководень і органічні сполуки сірки, тому газ ретельно очищають від цих домішок.
Виділення сірководнюз газів може здійснюватися сухими і мокрими методами.
До сухих методів належить поглинання сірководню твердою масою, яка складається з гідроксиду заліза, з добавлянням оксиду кальцію і деревних ошурок. На цій масі сірководень взаємодіє з активним гідроксидом заліза з утворенням сульфіду заліза:
Fe2O3 ∙ ХН2О + 3H2S ® Fe2S3 ∙ ХН2О + 3Н2О.
Сульфід заліза окиснюється киснем повітря:
Fe2S3 ∙ XH2O + 3O2 ® 2Fe2O3 ∙ XH2O + 6S.
Маса, в якій нагромадилося до 50 % сірки, вивантажується і використовується як сировина для виробництва сульфітного газу.
З мокрих методівнайбільше поширення мають циклічні способи поглинання сірководню миш'яково-содовим розчином і розчином етаноламіну. За першим способом процес полягає у поглинанні H2S в абсорбері лужним розчином окситіомиш'якових солей:
Na3AsS3O + H2S ® Na3AsS4 + Н2О.
Розчин з абсорбера надходить у регенератор, в якому продувається повітрям; при цьому виділяється елементарна сірка:
Na3AsS3O + 0,502 ® Na3AsS4 + S.
Розчин знову повертається в абсорбер.
Поглинання сірководню розчином моноетаноламіну NН2СН2СН2ОН в абсорбері відбувається при температурі 20‑30 °С за рівнянням реакції
2NH2CH2CH2OH + H2S  S(NH3CH2CH2OH)2.
S(NH3CH2CH2OH)2.
У десорбері піднімають температуру до 100 °С і змінюється напрям цієї реакції. При цьому отримують концентрований сірководень і регенерують абсорбент.
Очищення конвертованого газу.У конвертованому газі поряд з азотом і воднем міститься вуглецю диоксид (СО2), а також невелика кількість сірководню (до 0,1 %). Оксиди вуглецю і сірководень є сильними отрутами для каталізатора синтезу амоніаку, тому синтез-газ повинен бути ретельно очищений від цих домішок.
Очищення газу здійснюють різними методами: адсорбцією домішок твердими сорбентами; абсорбцією рідкими сорбентами; конденсацією домішок глибоким охолодженням; каталітичним гідруванням. Очищення твердими сорбентами у промисловій практиці трапляється рідко. Очищення методом конденсації застосовується при отриманні азотоводневої суміші з коксового газу. Каталітичне гідрування використовується як завершальна стадія для усунення невеликих кількостей CO, CO2 і О2 у колоні передкаталізу, яка встановлюється безпосередньо перед колоною синтезу амоніаку. Найбільше значення у промисловій практиці має метод очищення рідкими сорбентами, в основі якого лежать типові абсорбційно-десорбційні процеси.
Очищення конвертованого газу від СО2здійснюється у дві стадії: поглинанням холодною водою під тиском 1,6‑2,5 МПа; поглинанням решти СО2 водними розчинами лугів або етаноламіну. Процес відмивання газу від СО2 здійснюють у скруберах – колонах з насадкою, в яких газ зрошується зверху протитечією холодної води. Залишковий вміст СО2 у відмитому газі становить 1,5‑2 %.
Друга стадія очищення від СО2 – поглинання водними розчинами лугів або частіше моноетаноламіну також здійснюється у промивних колонах з насадкою. СО2 абсорбується моноетаноламіном при 35‑40 °С за рівнянням реакції
2NH2CH2CH2OH + Н2О + СО2  (HOCH2CH2NH3)2CO3.
(HOCH2CH2NH3)2CO3.
Утворені у результаті абсорбції карбонати або гідрокарбонати аміну розкладаються при 105‑125 °С з виділенням СО2 і регенерацією моноетаноламіну, який після охолодження знову подається на абсорбцію. Виділений висококонцентрований вуглецю диоксид (до 99 % СО2) можна використовувати для виробництва карбаміду, соди, сухого льоду і т. ін. Після очищення синтез-газів залишається не більше 0,003 % СО2.
Очищення від СО –найчастіше здійснюється амоніачними розчинами солей міді (І), які поглинають CO з утворенням комплексних сполук. Застосовують солі слабких кислот вугільної, мурашиної та оцтової.