 |
|
Обчислення результатів досліду.
Визначення твердості води. Загальну твердість води визначають комплексонометричним, ваговим або об'ємним методами. Комплексонометричний метод полягає в тому, що іони кальцію і магнію зв'язуються трилоном Б у комплексні сполуки за таким аналогічним для  і
і 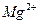
 рівнянням реакції:
рівнянням реакції:

Кінець реакції спостерігають за зміною кольору індикатора еріохрому чорного Т (азобарвника з двома фенольними групами поблизу хромофорної азогрупи), який застосовується для титрування при рН =7—11. У цьому інтервалі сам індикатор має синій колір, а з деякими металами, в тому числі з кальцієм і магнієм, він утворює комплексні сполуки вишнево-червоного кольору:
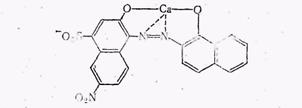
Щоб створити потрібну величину рН, до води перед титруванням додають буферний розчин, який приготовляють змішуванням однакових об’ємів 20%-них розчинів гідроксиду і хлориду амонію
Для приготування 1  0,1 н розчину трилону Б беруть наважку солі 18,6 г. Щобприготувати індикатор 0,5 г еріохрому чорного Т розчиняють у суміші 80
0,1 н розчину трилону Б беруть наважку солі 18,6 г. Щобприготувати індикатор 0,5 г еріохрому чорного Т розчиняють у суміші 80  етанолу з 20
етанолу з 20  буферного розчину.
буферного розчину.
Для проведення аналізу в конічну колбу на 250  наливають 100
наливають 100  досліджуваної води, додають 5
досліджуваної води, додають 5  буферного розчину, 5—6 крапель індикатора і повільно титрують розчином трилону Б до зміни вишнево-червоного забарвлення на синє з зеленкуватим відтінком. Загальну твердість води
буферного розчину, 5—6 крапель індикатора і повільно титрують розчином трилону Б до зміни вишнево-червоного забарвлення на синє з зеленкуватим відтінком. Загальну твердість води  (мг-екв/
(мг-екв/ 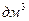 ) обчислюють за формулою:
) обчислюють за формулою:
 .
.
де  — об'єм розчину трилону Б, витраченого на титрування,
— об'єм розчину трилону Б, витраченого на титрування,  ;
; 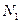 — нормальність розчину трилону Б;
— нормальність розчину трилону Б; 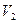 — об'єм води, взятої для визначення,
— об'єм води, взятої для визначення,  .
.
Карбонатну твердість визначають титруванням 100  води 0,1 н. .розчином НС1 з метилоранжем. Тоді
води 0,1 н. .розчином НС1 з метилоранжем. Тоді

де 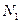 — нормальність НС1;
— нормальність НС1;
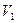 — об'єм соляної кислоти, витраченої на титрування,
— об'єм соляної кислоти, витраченої на титрування,  ;
; 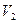 — об'єм води, взятої для аналізу,
— об'єм води, взятої для аналізу,  .
.
Некарбонатну твердість визначають за різницею між загальною і карбонатною твердістю:

Визначення вмісту іонів  у воді проводять титруванням розчином нітрату срібла в присутності індикатора хромату калію. При цьому в розчині відбуваються такі реакції:
у воді проводять титруванням розчином нітрату срібла в присутності індикатора хромату калію. При цьому в розчині відбуваються такі реакції:
 (осад білого коліру)
(осад білого коліру)
 (осад цегляно-червоного коліру)
(осад цегляно-червоного коліру)
Спочатку відбувається випадання менш розчиненого осаду АgС1, а потім, після закінчення випадання осаду хлориду срібла, починає утворюватись більш розчинний цегляно-червоний осад 
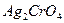 . Кінець реакції зв’язування іонів хлору в хлорид срібла визначають при появі цегляно-червоного забарвлення розчину внаслідок випадання осаду хромату срібла.
. Кінець реакції зв’язування іонів хлору в хлорид срібла визначають при появі цегляно-червоного забарвлення розчину внаслідок випадання осаду хромату срібла.
Для визначення вмісту  беруть 10
беруть 10  води в конічну колбу на 100
води в конічну колбу на 100  , доливають 1
, доливають 1  10%-го розчину хромату калію і титрують розчином нітрату срібла до з’явлення цегляно-червоного забарвлення. Відмічають об’єм розчину нітрату срібла, що пішов на титрування.
10%-го розчину хромату калію і титрують розчином нітрату срібла до з’явлення цегляно-червоного забарвлення. Відмічають об’єм розчину нітрату срібла, що пішов на титрування.
Кількість іонів хлору С (мг/ 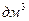 ) в досліджуваній воді вираховують за формулою:
) в досліджуваній воді вираховують за формулою:
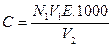
де 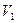 — об'єм розчину нітрату срібла, що витрачено на титрування,
— об'єм розчину нітрату срібла, що витрачено на титрування,  ;
;  — нормальність розчину нітрату срібла; Е — еквівалентна маса хлору, мг-екв;
— нормальність розчину нітрату срібла; Е — еквівалентна маса хлору, мг-екв; 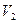 — об'єм досліджуваної води, взятий для титрування,
— об'єм досліджуваної води, взятий для титрування,  .
.
Визначення вмісту іонів 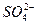 у воді проводять комплексонометричним методом за допомогою трилону Б. Трилон Б утворює комплексні сполуки з іонами
у воді проводять комплексонометричним методом за допомогою трилону Б. Трилон Б утворює комплексні сполуки з іонами  . Суть методу полягає в тому, що у воду вводять іони
. Суть методу полягає в тому, що у воду вводять іони  , які зв’язують іони
, які зв’язують іони 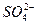 , в результаті чого випадає осад:
, в результаті чого випадає осад:

Кількість іонів сульфату визначають за різницею витрати трилону Б на зв’язування іонів  до і після осадження іонів сульфату. Якщо у воді виявлені іони
до і після осадження іонів сульфату. Якщо у воді виявлені іони  і
і 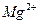 , то при розрахункках вносять відповідні поправки.
, то при розрахункках вносять відповідні поправки.
Для визначення іонів 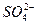 в конічну колбу на 250
в конічну колбу на 250  наливають 50
наливають 50  досліджуваної води, додають 1—2 краплини індикатору метилового червоного і підкислюють 0,1н. розчином НС1. Для видалення вуглекислоти розчин кип'ятять на протязі З -5 хв. До киплячого розчину додають 1
досліджуваної води, додають 1—2 краплини індикатору метилового червоного і підкислюють 0,1н. розчином НС1. Для видалення вуглекислоти розчин кип'ятять на протязі З -5 хв. До киплячого розчину додають 1  розчину
розчину 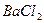 , в якому містяться і іони магнію ( в 1
, в якому містяться і іони магнію ( в 1 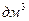 розчину міститься 10 г
розчину міститься 10 г  і 4г
і 4г  ) і ще нагрівають 10— 15 с. Присутність в розчині іонів
) і ще нагрівають 10— 15 с. Присутність в розчині іонів 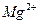 сприяє чіткому визначенню кінця титрування.
сприяє чіткому визначенню кінця титрування.
Через 10—15 хв досліджуваний розчин нейтралізують 0,1 н. розчином 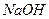 до переходу червоного забарвлення розчину в жовте. Потім доливають
до переходу червоного забарвлення розчину в жовте. Потім доливають
5  аміачного буферного розчину, декілька краплин еріохрому чорного Т і титрують 0,05 н. розчином трилону Б (
аміачного буферного розчину, декілька краплин еріохрому чорного Т і титрують 0,05 н. розчином трилону Б ( 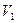 ).
).
В окремій пробі визначають об’єм розчину трилону Б ( 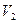 ), необхідного для титрування 1
), необхідного для титрування 1  розчину
розчину 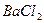 , який містить іони магнію. Визначають також обєм розчину трилону Б (
, який містить іони магнію. Визначають також обєм розчину трилону Б (  ), потрібного для титрування іонів
), потрібного для титрування іонів  і
і 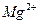 , які можуть бути присутні в досліджуваній воді. Вміст іонів
, які можуть бути присутні в досліджуваній воді. Вміст іонів 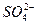 С ( мг/
С ( мг/ 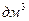 ) визначають за формулою :
) визначають за формулою :

де N — нормальність розчину трилону Б;Е — еквівалентна маса іону  , мг-екв;
, мг-екв;
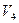 - обєм досліджуваної води,
- обєм досліджуваної води,  .
.
Результати обчислень заносять до таблиці.
Контрольні питання
1. Як видаляють з води грубодисперсні домішки?
2. Як видаляють з води домішки колоїдного ступеня дисперсності?
3. Як видаляють з води органічні домішки?
4. Як видаляють з води домішки іонного ступеня дисперсності?
5. Як видаляють залізо з води ?
6. Як проводять пом’якшення води?
8. Як знесолюють воду?
9. Як проводять іонітну очистку води?
10. Що таке катіоніти та аніоніти ? Наведіть приклади.
11. Які речовини використовують для пом’якшення води?
12. Які реакції супроводять пом’якшення води?