 |
|
Температура, теплота, теплоёмкость
Температураявляется свойством, которое характеризует тепловое равновесие между телами. Тела оказываются в тепловом равновесии, когда между ними нет самопроизвольного перехода теплоты. Если состояние А находится в тепловом равновесии с состоянием В, а состояние В – в тепловом равновесии с состоянием С, то состояние А будет также находиться в тепловом равновесии с состоянием С. Эта зависимость проявляет общий характер, и её иногда называют нулевым законом термодинамики.
Если тела, находящиеся в контакте, имеют разные температуры, то теплота будет переходить от нагретого тела к холодному (это одна из формулировок второго закона термодинамики).
Тела могут обладать различными видами энергии, но они не могут обладать теплотой.
Теплота q обычно обнаруживается как форма кинетической энергии, которая переходит от одного тела к другому при разности температур между ними. То же самое можно сказать о теплообмене между системой и окружением. Как и другие формы энергии, теплоту измеряют в джоулях (Дж). Ранее единицей энергии была калория (кал). Соотношение между ними:
4,184 Дж = 1 кал.
Знак теплоты q определяют в зависимости от того, приводит ли теплообмен к повышению или понижению энергии системы. Согласно термодинамической системе знаков если система принимает теплоту из окружающего пространства, то теплоте приписывают положительный знак (q > 0). Такой процесс является эндотермическим. При передаче теплоты из системы в окружающее пространство энергия системы понижается, и в этом случае принято считать, что теплота имеет отрицательный знак (q < 0), процесс является экзотермическим.
Если тело (вещество) поглощает теплоту, то его температура повышается. Между количеством теплоты, поглощенной (отданной) веществом, и изменением температуры вещества существует прямая пропорциональная зависимость:
q = C× m× (T2-T1), (6.1)
где С – удельная теплоёмкость вещества; m – масса вещества.
Нередко употребляется термин «тепловой эффект химической реакции» Q, который равен теплоте, выделенной или поглощенной системой при протекании в ней химической реакции*. Уравнение химической реакции, в котором указаны тепловой эффект и фазовое состояние веществ, называют термохимическим уравнением.
При измерении теплового эффекта требуется соблюдение следующих условий: система в ходе химической реакции не должна совершать работы иной, чем работа расширения, и температуры продуктов реакции и исходных веществ должны быть равны. Удельная теплоёмкость есть теплота, которая требуется, чтобы повысить температуру одного грамма вещества на один градус по шкале Цельсия (или по шкале Кельвина), Дж / (г×°С). Желательно, чтобы при определении теплоемкости разность температур была наименьшей, т.е.
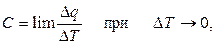
т.к. величина теплоемкости веществ зависит от температуры и принимается постоянной в небольших интервалах температур.
Молярная теплоемкость.Если количество вещества выразить в молях, то получим молярную теплоёмкость Сn, Дж / (моль × °С).
q = Cn× n(T2-T1), (6.2)
где Сn – молярная теплоёмкость вещества; n – число молей вещества.
Энтальпия
Величину qР определили как новый термодинамический параметр – изменение энтальпии:
qР= DН. (6.4)
Следовательно, при постоянном давлении
DН = DU + nРDV. (6.5)
Нельзя забывать, что уравнение (6.5) справедливо при обязательном условии: осуществляется только работа РDV и не совершаются другие типы работы, например, электрическая.
6.4. Изменение энтальпии DН и его измерение
Абсолютные значения внутренней энергии и энтальпии веществ не известны, но их изменения поддаются точному измерению.
Энтальпия является функцией состояния системы, и её изменение наблюдается при переходе системы из одного состояния в другое. Изменение состояния системы может происходить в результате физических или химических превращений. Если в результате превращения система перешла от исходного состояния, энтальпию которого условно обозначим Н1, к конечному, его энтальпию обозначим Н2, то изменение энтальпии
DН = Н2 – Н1.
В химических реакциях за исходное состояние принимают реагенты, а за конечное – продукты реакции. Тогда
DН = Нпродукты – Нреагенты.(6.9)
Изменение энтальпии в результате химической реакции, или qр (6.4) измеряют с помощью прибора, который называют калориметром, а метод измерения – калориметрией.
Заметим, что если реакция протекает в сосуде, сохраняющем объем системы неизменным, то измеряемая теплота реакции дает DU, а если реакция идет при постоянном давлении, то измеряют DН. Поскольку необходимо определить величину qр, измерение осуществляют при постоянном Р, по возможности равном атмосферному давлению. Заметим, что если измеряется DU или DН, то между ними возможен перерасчет с помощью уравнения
DН = DU + D(РV).
Если в реакции участвуют газы, можно пренебречь объемами жидких и твердых веществ и использовать уравнение идеального газа.
Химические реакции могут сопровождаться как выделением (экзотермические), так и поглощением (эндотермические) теплоты. При экзотермических реакциях q отрицательна, DU отрицательна при постоянном объеме и DН отрицательна при постоянном давлении. При эндотермических реакциях q положительна, DU положительна при постоянном объеме и DН положительна при постоянном давлении.