 |
|
Стандартная энтальпия образования
В термодинамике при выполнении расчётов используют не абсолютные значения, а изменения энергии системы. Поэтому можно было произвольно выбирать базис, или начало отсчёта, энергетических величин. При выборе остановились на соглашении о стандартных условиях и стандартном состоянии веществ.
Стандартные условия – это прежде всего давление 1 атм (101325 Па). Температура в определение стандартных условий не входит. Тем не менее все табличные данные термодинамических функций приведены для 298 K (точнее, 298,15 K ), или 25 ºС.
Стандартное состояние – наиболее стабильное состояние простых веществ при давлении 1 атм. В термодинамике принято условие равенства нулю энтальпий всех простых веществ в стационарном состоянии. Исходя из этого условия, вычисляют энтальпии образования сложных веществ и изменение энтальпии в ходе реакций.
Стандартная энтальпия образования соединения 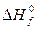 равна энтальпии реакции получения 1 моль соединения из составляющих его простых веществ в их стандартных состояниях.
равна энтальпии реакции получения 1 моль соединения из составляющих его простых веществ в их стандартных состояниях.
Символ  означает энтальпию образования вещества из простых веществ. Верхний индекс выражает давление 1 атм и наиболее стабильную форму простых веществ, а нижний символ f указывает на энтальпию образования (formation).
означает энтальпию образования вещества из простых веществ. Верхний индекс выражает давление 1 атм и наиболее стабильную форму простых веществ, а нижний символ f указывает на энтальпию образования (formation).
Например дано уравнение реакции
С(графит) + О2(г) = СО2(г),  (СО2) – 393,5 кДж/моль СО2(г).
(СО2) – 393,5 кДж/моль СО2(г).
Оно означает, что при образовании 1 моль СО2(г) из простых веществ в их стандартных состояниях, С(графит) и О2(г), из системы выделяется (об этом говорит знак минус) теплота (qР) в количестве 393,5 кДж/моль. В стандартных условиях наиболее стабильной формой углерода является графит, а кислорода – газ О2. В выражении  (СО2) температура 298 K не указана, что допускается.
(СО2) температура 298 K не указана, что допускается.
Рассмотрим еще один пример. Реакция образования Н2О(ж) из простых веществ:
Н2(г) +1/2О2(г) ® Н2Оf(ж),  (Н2О) = –286 кДж/моль Н2О(ж).
(Н2О) = –286 кДж/моль Н2О(ж).
Однако величина энтальпии образования Н2О(г), т.е. воды в виде пара, будет иной:
Н2(г) +1/2О2(г) ® Н2Оf(г),  (Н2О) = –242 кДж/моль Н2О(г).
(Н2О) = –242 кДж/моль Н2О(г).
Обратите внимание, что в приведенных уравнениях реакций у химической формулы каждого вещества приведен подстрочный символ, который указывает на агрегатное состояние вещества. Используют символы: «г» – газ, «ж» – жидкое состояние, «к» – твердое кристаллическое состояние.
Значения  для многих соединений приведены в справочной литературе. Для избранных веществ они даны в приложении 10.
для многих соединений приведены в справочной литературе. Для избранных веществ они даны в приложении 10.
Используя известные значения  продуктов реакции и исходных реагентов, вычисляют изменение энтальпии в результате химической реакции, DН°. Величину DН° обычно называют просто энтальпиейреакции.
продуктов реакции и исходных реагентов, вычисляют изменение энтальпии в результате химической реакции, DН°. Величину DН° обычно называют просто энтальпиейреакции.