 |
|
Реакции активных частиц
Активные частицы вступают в реакции, характер которых зависит от природы растворенного вещества. Наиболее частыми, однако, являются окисление при взаимодействии с ОН-радикалами, восстановление при взаимодействии с атомами Н и сольватированными электронами, а также нейтрализация ионов сольватированными электронами.
Реакции в шпорах, завершающиеся примерно через 10-8 секунд после поглощения энергии, приводят к образованию в соответствии с уравнениями (9) – (18) таких продуктов, как радикалы, сольватированные заряженные частицы, молекулярный водород и перекись водорода, образующиеся в последующих реакциях. Многие реакции этих активных частиц друг с другом и с молекулами воды хорошо изучены; для них удалось измерить константы скоростей:
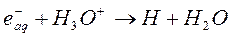
 (22)
(22)
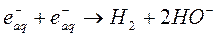
 (23)
(23)
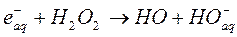
 (24)
(24)

 (25)
(25)

 (26)
(26)

 (27)
(27)

 (28)
(28)

 (29)
(29)

 (30)
(30)

 (31)
(31)

 (32)
(32)

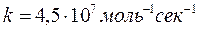 (33)
(33)
 pH=0,4
pH=0,4  (34)
(34)
pH=2,7 
pH=5,5 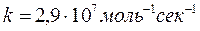
В водных системах существуют две восстанавливающие активные частицы – гидратированный электрон  и атомарный водород Н. Во многих системах реакции обеих частиц приводят к появлению одинаковых продуктов. Это задержало открытие гидратированного электрона до тех пор, пока кинетическими методами не удалось доказать существование двух типов восстанавливающих частиц.[2]
и атомарный водород Н. Во многих системах реакции обеих частиц приводят к появлению одинаковых продуктов. Это задержало открытие гидратированного электрона до тех пор, пока кинетическими методами не удалось доказать существование двух типов восстанавливающих частиц.[2]
Гидратированные электроны превращаются в водородные атомы в следующих реакциях:
 (35)
(35)
 (36)
(36)
Реакция (35) – медленная, тогда как реакция (36) идет очень быстро. В кислых растворах  быстро превращается в атомы Н, и тогда набор активных частиц в системе сводится лишь к двум радикалам – Н и НО. Например, в кислых 0,1 М растворах гидратированный электрон превращается в водородный атом за 10-9 – 10-10 секунд. В нейтральных и щелочных растворах это не так, поэтому могут встречаться различные промежуточные продукты. Сходство между реакциями гидратированного электрона и атомарного водорода можно проиллюстрировать следующими примерами:
быстро превращается в атомы Н, и тогда набор активных частиц в системе сводится лишь к двум радикалам – Н и НО. Например, в кислых 0,1 М растворах гидратированный электрон превращается в водородный атом за 10-9 – 10-10 секунд. В нейтральных и щелочных растворах это не так, поэтому могут встречаться различные промежуточные продукты. Сходство между реакциями гидратированного электрона и атомарного водорода можно проиллюстрировать следующими примерами:
1.) 
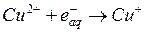 ;
;
2.) 

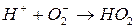
Реакции, в которых сольватированный электрон и атомарный водород дают различные продукты, идут с перекисью водорода и хлоруксусной кислотой. В первом случаи:
 (37)
(37)
 (38)
(38)
В разбавленных растворах хлоруксусной кислоты можно наблюдать второй случай:
 (39)
(39)
 (40)
(40)
Появление в растворе  позволяет отличить реакции.[2]
позволяет отличить реакции.[2]
Так как у гидратированного электрона имеется свой спектр поглощения, то с помощью метода импульсного радиолиза удается непосредственно измерить константы скоростей многих реакций, в которых участвует  . В методе импульсного радиолиза реакции гидратированного электрона можно сравнительного просто отличить от реакций атома Н, так как при столь высокой интенсивности излучения появляется возможность провести спектральные измерения. Гидратированный электрон представляет собой гораздо более мощный восстанавливающий агент, чем атом Н. Окислительно-восстановительный потенциал Е0 атомарного водорода равен -2,1 в, тогда как для гидратированного электрона Е0 равен -2,56 в. Следовательно, гидратированный электрон на 0,46 в более сильный восстановитель, чем атом Н. Эти значения рассчитаны Баксендейлом. Примененный им метод может служить примером определения окислительно-восстановительного потенциала.
. В методе импульсного радиолиза реакции гидратированного электрона можно сравнительного просто отличить от реакций атома Н, так как при столь высокой интенсивности излучения появляется возможность провести спектральные измерения. Гидратированный электрон представляет собой гораздо более мощный восстанавливающий агент, чем атом Н. Окислительно-восстановительный потенциал Е0 атомарного водорода равен -2,1 в, тогда как для гидратированного электрона Е0 равен -2,56 в. Следовательно, гидратированный электрон на 0,46 в более сильный восстановитель, чем атом Н. Эти значения рассчитаны Баксендейлом. Примененный им метод может служить примером определения окислительно-восстановительного потенциала.
Основными окислительными агентами в облученной воде являются НО-радикалы. В ряде случаев, однако, следует учитывать вклад вторичных активных частиц – радикалов НО2 и Н2О3, ионов  и
и  . Эти активные частицы наблюдаются при облучении насыщенной кислородом воды. Радикалы НО2 образуются в результате реакций:
. Эти активные частицы наблюдаются при облучении насыщенной кислородом воды. Радикалы НО2 образуются в результате реакций:
 ; (41)
; (41)
 ; (42)
; (42)
 , (43)
, (43)
 (44)
(44)
Частицы Н2О3 образуются только при облучении с высокой мощностью дозы по реакции:
 (45)
(45)
При обычных интенсивностях облучения концентрация НО- и НО2-радикалов недостаточно высока, чтобы привести к образованию Н2О3. Чаще эти радикалы участвуют в других реакциях, в которых возникают другие типы продуктов.[1]
Гидроксильный радикал обнаруживает сходство с очень слабой кислотой и при достаточно высоких рН диссоциирует:
 (46)
(46)