 |
|
Кинетика радиолиза воды и водных растворов
Кинетика радиационно-химических реакций, если учитывать неоднородность концентраций возникающих активных частиц, распределяющихся по шпорам, очень сложна. В кинетических расчетах необходимо учитывать процессы диффузии активных частиц из областей с большей концентрацией в области с меньшей концентрацией. Строгое рассмотрение кинетики радиационно-химических процессов возможно, но оно приводит к системам нелинейных дифференциальных уравнений в частных производных, решение которых трудно даже с использованием ЭВМ. Обычно такие уравнения решают, делая ряд упрощающих предположений, т. е. получают приближенные решения.[4]
Кинетика реакций в разбавленных водных растворах часто может быть описана простым уравнением:
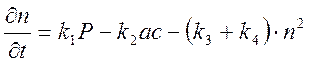 (93)
(93)
где  - изменение концентрации радикалов со временем; Р – мощность дозы, т. е. поглощенная энергия излучения, отнесенная к единице времени; с - концентрация растворенного вещества;
- изменение концентрации радикалов со временем; Р – мощность дозы, т. е. поглощенная энергия излучения, отнесенная к единице времени; с - концентрация растворенного вещества;  - число радикалов, образовавшихся на единицу дозы (за исключением тех радикалов, которые не могут выйти из области пространства, в которой они образовались; последние не встречают молекул растворенного вещества и, следовательно, не участвуют вреакциях его превращения под влиянием излучения);
- число радикалов, образовавшихся на единицу дозы (за исключением тех радикалов, которые не могут выйти из области пространства, в которой они образовались; последние не встречают молекул растворенного вещества и, следовательно, не участвуют вреакциях его превращения под влиянием излучения);  - константа скорости реакции гибели радикалов путем взаимодействия с растворенным веществом;
- константа скорости реакции гибели радикалов путем взаимодействия с растворенным веществом;  - константа скорости рекомбинации радикалов путем соударения с молекулами жидкости;
- константа скорости рекомбинации радикалов путем соударения с молекулами жидкости;
 - константа скорости реакции взаимодействия радикалов.
- константа скорости реакции взаимодействия радикалов.
В то время как концентрация с одинакова во всем объеме системы, число радикалов в 1 см3 никогда не бывает одинаковым из-за потери энергии, ионизирующей частицы вдоль шпоры. Характер и степень неоднородности должны учитываться при рассмотрении уравнения (93). По этой причине результаты расчетов по нему дают только качественную характеристику процесса.
Скорость химической реакции характеризуется скоростью исчезновения растворенного вещества:
 (94)
(94)
где  - вероятность того, что при исчезновении радикала в результате взаимодействия с растворенной молекулой последняя изменяется химически.[4]
- вероятность того, что при исчезновении радикала в результате взаимодействия с растворенной молекулой последняя изменяется химически.[4]
Концентрацию радикалов, входящую в формулу (94), можно найти для стационарного состояния, когда
 (95)
(95)
или
 (96)
(96)
Если
 (97)
(97)
то последним членом в выражении (96) можно пренебречь и, следовательно:
 (98)
(98)
Откуда легко найти  . Подставляя его в выражение (94), находим
. Подставляя его в выражение (94), находим
 (99)
(99)
т. е. в этом случае скорость изменения концентрации растворенного вещества не зависит от его концентрации. Дифференциальный ионный выход, определенный как частное от деления скорости реакции на скорость образования пар ионов в данный момент при этом не зависит ни от концентрации растворенного вещества, ни от мощности дозы. Если же
 (100)
(100)
то в выражении (96) можно пренебречь вторым слагаемым, тогда
 (101)
(101)
откуда
 (102)
(102)
Подставляя (102) в (94), получаем
 (103)
(103)
т.е. скорость изменения концентрации растворенного вещества прямо пропорциональна его концентрации и квадратному корню из мощности дозы.
Образующиеся радикалы могут реагировать не только с исходными веществами, но и с продуктами реакции. В этом случае кинетическое уравнение (93) надо записать в виде
 (104)
(104)
где с1 и с2 – концентрация исходного и образующегося вещества соответственно.
Если  , то выражение (104) можно записать
, то выражение (104) можно записать
 (105)
(105)
где  .
.
Для случая, когда выполняется соотношение (97)
 (106)
(106)
Отсюда находим
 (107)
(107)
Подставляя (107) в (94), получаем
 (108)
(108)
Интегрируя это выражение, находим
 (109)
(109)
т. е. концентрация растворенного вещества экспоненциально уменьшается с увеличением поглощенной дозы. Такая зависимость наблюдается для реакции окисления гемоглобина в метгемоглобин под действием рентгеновских лучей.[4]
Выводы
1.) В курсовой работе рассмотрены вопросы радиолиза воды и водных растворов. Как мы выяснили радиолиз это распад вещества под действием ионизирующего излучение, при чем продуктами распада могут быть как радикалы, так и нейтральный молекулы. Чаще всего применяют  -излучения, так как энергии квантов
-излучения, так как энергии квантов  - и
- и  -излучения обычно мало для разложения воды и водных растворов. Разложение воды радиолизом приводит к образованию довольно большого количества радикалов, а также нескольких молекулярных продуктов, таких как водород и перекись водорода. Среднее расстояние между образующимися первичными активными частицами зависит от скорости ионизирующей частицы и ее заряда. Причем чем выше энергия ионизирующей частицы, тем больше расстояние. Также следует учитывать что с ростом концентрации растворенных веществ молекулярные выходы Н2О2 и Н2 в процессе радиолиза уменьшаются.
-излучения обычно мало для разложения воды и водных растворов. Разложение воды радиолизом приводит к образованию довольно большого количества радикалов, а также нескольких молекулярных продуктов, таких как водород и перекись водорода. Среднее расстояние между образующимися первичными активными частицами зависит от скорости ионизирующей частицы и ее заряда. Причем чем выше энергия ионизирующей частицы, тем больше расстояние. Также следует учитывать что с ростом концентрации растворенных веществ молекулярные выходы Н2О2 и Н2 в процессе радиолиза уменьшаются.
2.) Основные активные частицы, которые образуются при радиолизе можно разделить на две группы: восстанавливающие активные частицы, к которым относятся гидратированный электрон  и атомарный водород Н, и окисляющие активные частицы, к которым относятся НО-радикалы. Эти и другие образующие частицы вступают в дальнейшие реакции, которые описаны в курсовой работе. Выходы молекул Н2 при радиолизе одинаков для различных разбавленных водных растворов в независимости от рН среды. Выход Н2О2 не удается определить столь же прямым и простым способом, как
и атомарный водород Н, и окисляющие активные частицы, к которым относятся НО-радикалы. Эти и другие образующие частицы вступают в дальнейшие реакции, которые описаны в курсовой работе. Выходы молекул Н2 при радиолизе одинаков для различных разбавленных водных растворов в независимости от рН среды. Выход Н2О2 не удается определить столь же прямым и простым способом, как  . Значения
. Значения  для различных систем будут отличаться, потому, что в отличие от выхода молекулярного водорода выход перекиси водорода зависит от рН среды. Значения
для различных систем будут отличаться, потому, что в отличие от выхода молекулярного водорода выход перекиси водорода зависит от рН среды. Значения  при увеличении рН уменьшается.
при увеличении рН уменьшается.
3.) Кинетика реакций радиолиза описывается уравнением (93)  . Скорость реакции зависит от: мощности дозы излучения, числа радикалов, образовавшихся на единицу дозы, константы скорости реакции гибели радикалов путем взаимодействия с растворенным веществом, константы скорости рекомбинации радикалов путем соударения с молекулами жидкости и константы скорости реакции взаимодействия радикалов.
. Скорость реакции зависит от: мощности дозы излучения, числа радикалов, образовавшихся на единицу дозы, константы скорости реакции гибели радикалов путем взаимодействия с растворенным веществом, константы скорости рекомбинации радикалов путем соударения с молекулами жидкости и константы скорости реакции взаимодействия радикалов.
4.) Скорость изменения концентрации растворенного вещества прямо пропорциональна его концентрации и квадратному корню из мощности дозы и описывается уравнением (103)  .
.
Литература
1. Пикаев А.К., Кабакчи С.А., Макаров И.Е., Ершов Б.Г. Импульсный радиолиз и его применение. – М.: Атомиздат, 1980. – 280 стр.
2. Хенли Э., Джонсон Э. Радиационная химия. Перевод с английского языка. – М.: Атомиздат, 1974. – 416 стр.
3. Пикаев А.К. Современная радиационная химия. Радиолиз газов и жидкостей. – М.: Наука, 1986. – 360 стр.
4. Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ. – М.: Химия, 1985. – 592 стр.
5. Пшежецкий С.Я. Механизм радиационно-химических реакций. – М.: Химия, 1968. – 368 стр.
6. Электронный ресурс. Точка доступа: http://dic.academic.ru/dic.nsf/dic_fwords/47413/радиолиз
7. Электронный ресурс. Точка доступа: http://www.mun.ca/biology/scarr/Radiolysis_of_Water.html
8. Электронный ресурс. Точка доступа: http://www.pereplet.ru/obrazovanie/stsoros/974.html