 |
|
Номенклатурасы, стереоизомериясы. 6 страница
· концентрлі ерітіндіден сұйылтылған ерітінді дайындау дағдыларын қалыптастыру;
· белгілі массасы бойынша ерітінді дайындауға және оның концентрациясын тәжірибелік жолмен таба білуге үйрету;
· орындалған лабораториялық жұмыстың нәтижелерін талдай білуге үйрету.
ТАҚЫРЫПТЫҢ НЕГІЗГІ СҰРАҚТАРЫ:
1. Ерітінділер теориясының негізгі түсініктері.
2. Ерітінділердің тірі ағза үшін маңызы.
3. Ерітінді құрамын өрнектеу тәсілдері.
4. Ерітінділердің медициналық тәжірибеде қолданылуы.
ОҚЫТУ әдістері:
Үйлескен түрде:
- материалды мәселелік түрде баяндау (студенттерде гипотезаларды ұсыну, алдын-ала қорытындылар және ойларын түйіндей білуді дамыту);
- кіші топтарда жұмыс жасау (лабораториялық жұмысты орындау)
САБАҚТЫҢ ХРОНОМЕТРАЖЫНА МЫСАЛ
| Кіріспе бөлім (ұйымдастыру кезеңі) | 5 мин | |
| Тақырып бойынша семинар және пікірталас | 25 мин | |
| Лаборияториялық жұмысты теориялық тұрғыдан талқылау | 20 мин | |
| ҮЗІЛІС | 10 мин | |
| Лабораториялық жұмысты орындау және талқылау | 25 мин | |
| Жазбаша бақылау | 20 мин | |
| Сабақты қорытындылау | 5 мин |
БАҚЫЛАУ
Бағаланатын құзыреттіліктер:
1) Білім.
2) Тәжірибелік дағдылар
Бақылау әдістері:
1. Тест тапсырмаларын орындау
2. Есептердің шығарылуын тексеру.
Бақылау сұрақтары
- Ерітінді, еріткіш, еріген зат түсініктеріне анықтама беріңіз. Еріитінділердің жіктелуі.
2. Су еріткіш ретінде. Сулы ерітінділердің ағза тіршілігіндегі маңызы. Диффузия дегеніміз не?
- Тіршілік процесіндегі диффузияның атқаратын рөлі. Мысалдар келтіріңіз.
- Массалық үлес. Анықтамасы, есептеу формуласы, өлшем бірлігі.
5. Молярлық концентрация дегеніміз не? Молярлық концентрацияның өлшем бірлігі.
6. Зат эквиваленті дегеніміз не? Эквиваленттік факторы. Қышқылдар, негіздер, тұздардың эквиваленттік факторы.
- Эквивалентінің молярлық концентрациясы. Анықтамасы, есептеу формуласы, өлшем бірлігі.
- Ерітінді титрі. Еріген заттың молялдық концентрациясы.Еріген заттың мольдік үлесі.
Әдебиет:
Негізгі:
3. Сейтембетов Т.С. Химия.- Алматы, 1994.- 23-37 б.
4. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия.- М., 2001.-101-131 б.
3. Ленский А.С.Введение в бионеорганическую и биофизическую химию.- М.: ВШ, 1989.- 55-92 б.
4. Веренцова Л.Г., Нечепуренко Е.В., Батырбаева А.Ә., Карлова Э.К. Бейорганикалық, физикалық және коллоидты химия: оқу құралы -29-47 б.
5. Есімжан А.Е. Жалпы химия практикумы- Алматы, 2004.- 102-120 б.
6. Рубина Х.М. и др. Практикум по физической и коллоидной химии. – М., 2001. – 71-89 б.
Қосымша:
1. Ершов Ю.А. и др. Общая химия. Биофизическая химия. Химия биогенных элементов.- М.: ВШ, 2003.- 391-422 б.
2. Слесарев В.И. Химия. Основы химии живого. - СПб.: Химиздат, 2001.- 96-123 б.
3. Ленский А.С., Белавин И.Ю., Быликин С.Ю. Биофизическая и бионеорганическая химия: медициналық ЖОО-на арналған оқу құралы.- М.:ООО «медицинское информационное агентство», 2008.- 174-178, 182-207 б.
4. Зеленин К.Н., Алексеев В.В. Химия.- С.-Пб.: ЭЛБИ-СПб, 2003.- 107-124 б.
5. Попков В.А., Пузаков С.А. Общая химия: құрал.- М.: ГЭОТАР-Медия, 2009.- 200-239 б.
6. Евстратова К.И. и др. Физическая и коллоидная химия. – М.: ВШ, 1990. - 260-302 б.
7. Бірімжанов Б.А. Жалпы химия: ЖОО-на арналған оқу құралы– Алматы.:Білім, 2001.
ҚОСЫМША
Лабораториялық жұмыс «Берілген концентрациясы бойынша ерітінді дайындау»
1-ші тәжірибе.«Концентрлі тұз қышқылы ерітіндісінен сұйылтылған ерітінді дайындау»
Жұмыстың мақсаты: шамамен концентрациясы 0,1 моль/л 250 мл ерітінді дайындау (оқытушы ерітінді көлемі мен концентрациясын топқа немесе әр студентке жеке беруі мүмкін)
Жұмыстың жүргізілуі: Концентрациясы 0,1 моль/л 250 мл ерітінді дайындау үшін тұз қышқылының массасын (г) молярлық концентрацияның формуласы арқылы есептейді: 
Сұйылтылған ерітіндінің тығыздығын 1,00 г/мл деп алуға болады (кестені қараңыз)
| | Ареометрмен тұз қышқылының бастапқы ерітіндісінің тығыздығын өлшейді де кесте бойынша концентрациясын анықтайды Ареометр ерітінділердің меншікті тығыздығын өлшеуге арналған құрал. Өлшеу үшін ерітінді құйылған цилиндрге ареометрді цилиндр қабырғаларына тигізбей батыру керек. Ерітінді тығыздығын ареометрдің қандай тереңдікке батқанын көрсететін шкала бөлігінен қарайды. Суретте ареометрдің цилиндрге дұрыс батырылуы және шкала бойынша анықтау көрсетілген. | |
|
| Тығыздық |
| Тығыздық |
| Тығыздық |

Массалық үлестің формуласы бойынша: 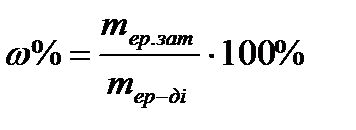
ерітінді массасын есептейді.
Ерітіндінің көлемін келесі формула арқылы есептейді:  .
.
Концентрлі ерітіндінің есептелген көлемін кішкентай цилиндрмен өлшеп алады да тығыны бар таза шыны ыдысқа құяды. Үлкен цилиндрмен судың қажетті мөлшерін өлшеп алады да шыны ыдыстағы ерітіндінің үстіне құйып араластырады. Шыны ыдысқа атауы және концентрациясы жазылған этикетка жапсырылады.
Қорытынды: қажетті есептеулер арқылы ерітіндінің концентрациясын есептеп шығарады.
2-ші тәжірибе.«Құрғақ тұздан ерітінді дайындау және оның концентрациясын анықтау»
Жұмыстың мақсаты: Шамамен 100 мл 0,9%-дық NaCl ерітіндісін дайындау (оқытушы ерітінді көлемі мен концентрациясын топқа немесе әр студентке жеке беруі мүмкін)
Жұмыстың жүргізілуі: Құрғақ тұзды ақырындап, төгіп алмай өлшеуін колбаға салады. Колбаның 2/3 деңгейіне дейін су құйып, тұз ерігенше араластырады. Ары қарай суды колбаның жіңішке мойнындағы белгіге 1-1,5 см жетпейтіндей деңгейге дейін құяды. Қалған суды пипеткамен алып белгіге жеткенше тамшылатып құяды.
Дайындалған ерітіндінің массалық үлесін келесі формула бойынша есептейді:
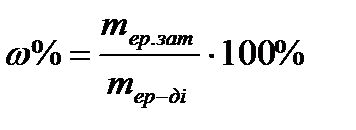
Кесте бойынша ерітінідінің тығыздығын анықтайды.
| | |
Барлық есептеулерді жүргізіп, алынған мәліметтерді кестеге жазады.
| Ерітінді | Концентрация | |||||||
| Тұздың массасы, г | Судың массасы, г | ρер-ді, г/мл | ω, % | С(х), моль/л | Сэ(х), моль/л | b(x), моль/кг | Т, г/мл | Мольдік үлес |
Қорытынды: дайындалған ерітіндінің концентрацияларын есептеп шығарады.
№3 тәжірибелік сабақ
ТАҚЫРЫБЫ: Протолиттік тепе-теңдік және процестер. Ерітінді рН-н колориметрлік әдіс арқылы тәжірибелік жолмен анықтау. Ерітінділердің буферлік сиымдылығын анықтау
МАҚСАТТАРЫ:
· ағзадағы протолиттік тепе-теңдіктер және процестерді сипаттайтын негізгі түсініктерді қалыптастыру;
· әр түрлі ерітінділердің сутектік көрсеткішін есептеуді және оны тәжірибелік жолмен колориметрлік әдіспен анықтауды үйрету;
· рН-ы әр түрлі буферлік ерітінділерді дайындау үшін есептеу білудің және ерітінділердің қышқыл мен негіз бойынша буферлік сыйымдылығын анықтай білудің дағдыларын қалыптастыру;
оқыту міндеттері:
· ерітіндідегі протолиттік тепе-теңдіктер және процестерді сипаттайтын негізгі түсініктерді қалыптастыру;
· буферлік ерітіндінің рН-н колориметрлік әдіспен іс жүзінде анықтауды көрнекілікті көрсету;
· рН-ы әр түрлі буферлік ерітінділерді дайындау үшін есептеу білуді үйрету;
· ерітіндінің буферлік сыйымдылығын қышқыл мен негіз бойынша есептеуді көрнекілікті көрсету;
· есептеу үшін қажетті мәндерді табу үшін анықтамалық әдебиеттерді дұрыс қолдана білуді дағдыландыру;
тақырыптың негізгі сұрақтары:
1. Судың иондық көбейтіндісі. Сутектік көрсеткіш рН – орта қышқылдығының сипаттамасы ретінде.
2. Буферлік жүйелер. Анықтамасы, жіктелуі, құрамы. Буферлік ерітінділердің рН-н есептеу (Гендерсон-Гассельбах теңдеуі). Буферлік әсер ету механизмі.
3. Ерітіндінің қышқыл мен негіз бойынша буферлік сыйымдылығы.
4. Қандағы буферлік жүйелер, олардың ағзаның қалыпты тіршілігін қамтамасыз етудегі биологиялық ролі. Ацидоз. Алкалоз. Буферлік сыйымдылық.
ОҚЫТУ әдістері:
Үйлескен түрде:
- материалды мәселелік түрде баяндау;
- кіші топтарда жұмыс (лабораториялық жұмыс жасау)
САБАҚТЫҢ ХРОНОМЕТРАЖЫНА МЫСАЛ
| Кіріспе бөлім (ұйымдастыру кезеңі) | 5 мин | |
| Тақырып бойынша семинар және пікірталас | 25 мин | |
| Лаборияториялық жұмысты теориялық тұрғыдан талқылау | 20 мин | |
| ҮЗІЛІС | 10 мин | |
| Лаборияториялық жұмысты орындау | 25 мин | |
| Лабораториялық жұмыс нәтижелерін есептеу және қорғау | 25 мин | |
| ҮЗІЛІС | 10 мин | |
| Буферлік ерітінділердің әсер ету механизмін талқылау | 25 мин | |
| Тақырып бойынша бақылау | 20 мин | |
| Сабақты қорытындылау | 5 мин |
БАҚЫЛАУ
1) Білім.
2) Тәжірибелік дағдылар.
Бақылау әдістері:
1. Ситуациялық есептердің шығарылуын тексеру
2. Тест тапсырмаларын орындау
Бақылау сұрақтары
1. Судың иондық көбейтіндісі. Ортаның сутектік көрсеткіші.
2. Буферлік жүйе деген не? Қышқылдық және негіздік буферлік жүйеге анықтама беріңіз, мысал келтіріңіздер, құрамын көрсетіңіздер. Буферлік ерітінділердің рН-н есептеу (Гендерсон-Гассельбах теңдеуі).
3. Қандағы буферлік жүйелерді тізіп шығыңыз. Олардың ағза үшін маңызы қандай? Қандағы буферлік жүйелердің күштілігінің салыстырмалы сипаттамасын келтіріңіз.
4. Буферлік жүйелердің әсер ету механизмі. Ацетатты және аммиакты буферлік жүйелерді мысалға ала отырып буферлік жүйелердің әсер ету механизмін түсіндіріңіз.
5. Буферлік ерітінділердің сутек иондарының концентрациясын, ортаның рН және рОН-н есептеу.
6. Ерітіндінің қышқыл мен негіз бойынша буферлік сыйымдылығын есептеу.
Әдебиет:
Негізгі:
1. Сейтембетов Т.С. Химия.- Алматы, 1994.- 44-62 б.
2. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия.- М., 2001.-77-100 б.
3. Ленский А.С.Введение в бионеорганическую и биофизическую химию.- М.: ВШ, 1989.- 126 - 165 б.
4. Веренцова Л.Г., Нечепуренко Е.В., Батырбаева А.Ә., Карлова Э.К. Бейорганикалық, физикалық және коллоидты химия: оқу құралы- Алматы: «Эверо», 2009.- 67-85 б.
5. Есімжан А.Е. Жалпы химия практикумы- Алматы, 2004.- 76-90 б.
6. Рубина Х.М. и др. Практикум по физической и коллоидной химии.–М., 2001.–14-38 б.
Қосымша:
1. Ершов Ю.А. және т.б. Общая химия. Биофизическая химия. Химия биогенных элементов.- М.: ВШ, 2003.- 80-119 б.
2. Слесарев В.И. Химия. Основы химии живого. - СПб.: Химиздат, 2001.- 153-207 б.
3. Ленский А.С., Белавин И.Ю., Быликин С.Ю. Биофизическая и бионеорганическая химия: медициналық ЖОО-на арналған оқу құралы.- М.:ООО «медицинское информационное агентство», 2008.- 241-327 б.
4. Зеленин К.Н., Алексеев В.В. Химия.- С.-Пб.: ЭЛБИ-СПб, 2003.- 144-164 б.
5. Попков В.А., Пузаков С.А. Общая химия: құрал.- М.: ГЭОТАР-Медия, 2009.- 575-623 б.
6. Евстратова К.И. және тағы басқалар. Физическая и коллоидная химия. – М.: ВШ, 1990. - 114-131 б.
7. Бірімжанов Б.А. Жалпы химия: ЖОО-на арналған оқу құралы– Алматы.:Білім, 2001.
ҚОСЫМША:
Көрнекілікті эксперимент«БУФЕРЛІК ЕРІТІНДІНІҢ рН-ЫН КОЛОРИМЕТРЛІК ӘДІСПЕН АНЫҚТАУ»
Жұмыстың мақсаты: рН мәні әртүрлі буферлік ерітінділер дайындап үйрену; колориметрлік әдіспен бақылау ерітіндісінің рН-ын тәжірибелік жолмен анықтау.
Жұмыстың маңызы:
Колориметрлік әдіспен ерітіндінің рН-ын анықтау зерттелетін ерітіндідегі индикатор бояуын сол индикатор қосылған бірнеше стандарт ерітінділерінің бояуымен көзбен шолып салыстыруға негізделген.
Стандарт ретінде әртүрлі сандық қатынастағы қышқылдар мен тұздардан буферлік қоспалар дайындайды, Гендерсон-Гассальбах теңдеуі бойынша әрбір қоспа үшін рН мәнін есептейді.
Жұмыстың орындалу барысы: Оқытушыдан бақылау ерітіндісі бар сынауық алыңыз. Зерттелетін ерітіндінің 1 тамшысын шыны таяқшамен әмбебап индикатор қағазының жолағына тамызыңыз. Индикатор қағазының бояуын стандартты рН шкаласымен салыстырыңыз.
Стандартты ерітінді ретінде дайындайтын буфер типін анықтаңыз. Төменде кестеде көрсетілген қышқылдар мен тұздардың көлемдік қатынастары үшін рН мәні ацетат буферлік қоспасында 4-тен 6-ға дейін, ал фосфат буферлік қоспасында 6-дан 8-ге дейін өзгеретінін ескеріңіз.
Егер зерттелетін ерітіндінің рН-ы шамамен 7-ге тең болса, онда қышқыл (NaH2PO4) және тұз (Na2НРO4) ерітінділерінің кестеде көрсетілген қатынастарын араластырып, бірнеше стандартты фосфат буферлік ерітінділерін дайындаңыз.
Егер зерттелетін ерітіндінің рН-ы шамамен 5-ке тең болса, онда қышқыл (СН3СООН) және тұз (СН3СООNa) ерітінділерінің кестеде көрсетілген қатынастарын араластырып, бірнеше стандартты ацетат буферлік ерітінділерін дайындаңыз.
5 буферлік қоспаны дайындап, рН мәндерін есептегеннен кейін, осы бес стандартты ерітіндісі бар сынауықтардың әрқайсысына 1-2 тамшы индикатор қосады (ацетат буферлік ерітіндісі үшін – метил қызылы, ал фосфат буферлік ерітіндісі үшін – бромтимол көгі).
Дәл сол индикаторды бақылау ерітіндісіне де қосыңыз. Бақылау ерітіндісі мен стандарттың бояуының сәйкес келуі, осы екі ерітіндінің де рН мәндерінің бірдей екенін көрсетеді.
Жұмыс нәтижелерін өңдеу:
Бақылау ерітіндісі мен стандарт ретінде таңдалған буферлік ерітіндісінің рН мәнін көрсетіңіз. Буферлік әсер ету механизмін көрсететін реакция теңдеуін жазыңыз.
Компоненттердің әртүрлі қатынастарындағы стандартты буферлік ерітінділердің [Н+] және рН мәндерін келесі формула бойынша есептейді:
 және
және  ,
,
| мұнда | |
| Са (Сs) - | қышқыл (тұз) ерітіндісінің концентрациясы; |
| Va (Vs) - | қышқыл (тұз) ерітіндісінің көлемі; |
| Ка - | қышқылдың иондану константасы |
Алынған мәліметтерді кестеге толтырыңыз.
| Сынауық № | Көлем, мл | Буферлік қоспа | ||||
| Қышқыл | Тұз | Ацетат буфері 0,1М СН3СООН 0,1М СН3СООNa Ка=1,8×10-5 | Фосфат буфері 0,1М NaH2PO4 0,1М Na2НРO4 Ка=1,6×10-7 | |||
| [Н+] | рН | [Н+] | рН | |||
| 0,5 | 4,5 | |||||
| 1,0 | 4,0 | |||||
| 1,5 | 3,5 | |||||
| 2,5 | 2,5 | |||||
| 4,0 | 1,0 |
Қорытынды: Бақылау ерітіндісінің рН мәнін көрсетіңіз.
Көрнекілікті эксперимент«ЕРІТІНДІНІҢ БУФЕРЛІК СЫЙЫМДЫЛЫҒЫН АНЫҚТАУ»
Жұмыстың мақсаты: Ерітіндінің буферлік сыйымдылығын қышқыл және негіз бойынша тәжірибемен анықтау.
Жұмыстың орындалу тәртібі: Бірінші және екінші колбаларға көлемдері бірдей компоненттерінің қатынасы 1:1 болатын 10 мл-ден екі ацетат буферлік ерітіндісін дайындайды (зерттелетін ерітінділер). Қышқыл және тұз ерітінділерінің концентрациялары 0,1 моль/л.
Үшінші және төртінші колбаларға натрий ацетаты мен сірке қышқылы ерітінділерін 1:9 қатынаста (3 колба үшін), 9:1 қатынаста (4 колба үшін) араластырады (куәгер ерітінділері).
Қышқыл бойынша буферлік сыйымдылықты анықтау. 1 және 3 колбаларға 5 тамшы метил қызыл сарысы ерітіндісін тамызады, ерітіндіні араластырады. 1 колбадағы зерттелетін ерітіндіні 3 колбадағы куәгер ерітіндісінің бояуымен бірдей бояу алынғанша 0,1М хлорсутек қышқылы ерітіндісімен титрлейді. Титрлеу нәтижелерін кестеге жазады.
Негіз бойынша буферлік сыйымдылықты анықтау. 2 және 4 колбаларға 5 тамшы метил қызылы ерітіндісін тамызады, ерітіндіні араластырады. 2 колбадағы зерттелетін ерітіндіні 4 колбадағы куәгер ерітіндісінің бояуымен бірдей бояу алынғанша 0,1М натрий гидроксиді ерітіндісімен титрлейді. Титрлеу нәтижелерін кестеге жазады.
Жұмыс нәтижелерін өңдеу:
| Колба | Ерітінді | 
| Титрлеуге дейінгі рН мәні | Титрант көлемі, мл | Титрлеуден кейінгі рН мәні | В, моль/л |
| Қышқыл бойынша (индикатор – метил қызыл сарысы) | ||||||
| Зерттелетін | 1:1 | |||||
| Куәгер | 1:9 | - | - | |||
| Негіз бойынша (индикатор – метил қызылы) | ||||||
| Зерттелетін | 1:1 | |||||
| Куәгер | 9:1 | - | - |
Титрлеуге дейін ерітіндінің рН-ын Гендерсон-Гассальбах теңдеуі бойынша есептейді. Қышқыл бойынша буферлік сыйымдылықты (Ва, моль/л) келесі формула бойынша есептейді:
 .
.
Негіз бойынша буферлік сыйымдылықты (Вb, моль/л) келесі формула бойынша есептейді:
 ,
,
| мұндағы | |
| С(HCl) - | хлорсутек қышқылы ерітіндісінің молярлық концентрациясы, моль/л; |
| С(NaOH) - | натрий гидроксиді ерітіндісінің молярлық концентрациясы, моль/л; |
| V(HCl) - | титрлеуге кеткен хлорсутек қышқылы ерітіндісінің көлемі, мл; |
| V(NaOH) - | титрлеуге кеткен натрий гидроксиді ерітіндісінің көлемі, мл; |
| Vб - | буферлік ерітіндінің көлемі, мл; |
| ΔрН - | рН(зерттелетін ерітінді) – рН(куәгер ерітіндісі). |
Қорытынды: Қышқыл және негіз бойынша анықталған зерттелетін ерітіндінің буферлік сыйымдылығының мәнін көрсетіңіз.
№4 Тәжірибелік сабақ
ТАҚЫРЫБЫ: Беттік құбылыстар және дисперсті жүйелер. Темір және мыс иондарын хроматографиялық әдіспен бөлу. Қағаздық хроматография әдісімен темір(ІІІ) иондарын сапалық анықтау. Коллоидты ерітінділерді тәжірибелік жолмен алу және олардың кейбір қасиеттерін зерттеу
МАҚСАТТАРЫ:
· адсорбция құбылысын сипаттайтын негізгі түсініктерді қалыптастыру;
· хроматографиялық әдіспен иондарды анықтау және бөлудің тәжірибелік дағдыларын қалыптастыру;
· дисперсті жүйелер және олардың жіктелуі, коллоидты ерітінділерді алу әдістері, мицелланың құрылысы туралы негізгі түсініктерді қалыптастыру;
· электролиттің коагуляция табалдырығы мен оның коагуляциялау қабілетін есептей білуді үйрету;
· дәрілік препараттарды, биологиялық сұйықтықтарды талдауда және соттық-медициналық сараптамада хроматографиялық әдістердің, сонымен қатар диализдің әртүрлі әдістерін медицинада қолданылу мүмкіндігін қарастыру арқылы студенттерде химияны зерттеу мотивациясын дамыта білу.
ОҚЫТУ МІНДЕТТЕРІ:
· заттарды хроматографиялық бөлу процесінің және ионалмасу адсорбция процесінің мәнін, оның медициналық-биологиялық мақсатта қолданылуын түсіндіру;
· қағаздық хроматография әдісімен темір (ІІІ) иондарын тәжірибелік жолмен анықтауды және бағаналық хроматография әдісімен иондарды бөлуді көрнекілікті көрсету;
· электролиттің коагуляциялау қабілеті мен оның коагуляция табалдырығы есептеу дағдыларын қалыптастыру;
· химиялық және физикалық конденсация әдістері бойынша коллоидты ерітінділерді тәжірибелік жолмен алынуын, капиллярлық талдау әдісімен коллоидты бөлшектердің зарядын анықтауды, диализ әдісімен коллоидты ерітінділерді тазартуды көрнекілікті көрсету;
· мицелланың формуласын жаза білуге және оны құрылысын түсіндіруге үйрету
тақырыптың негізгі сұрақтары:
1. Беттік құбылыстар. Адсорбция. Негізгі түсініктер.