 |
|
Единицы тепловых величин
Для получения производных единиц тепловых величин в системе СИ используются основные единицы: метр (м), килограмм (кг), секунда (с), кельвин (К).
В табл. 11 и 12 приводятся важнейшие производные единицы тепловых величин в системе СИ, а также внесистемные единицы, основанные на калории.
Единицы молярных величин образуются из перечисленных в табл.11 и 12 единиц удельных величин путем замены в них килограмма молем.
Таблица 11
| Величина | Единица | Размерность | ||
| определение | наименование | обозна-чение | величины | |
| Количество теплоты | Q = D U | джоуль | Дж | L2 M T –2 |
| Теплоемкость системы | C = DQ /DT | джоуль на кельвин | Дж/К | L2MT –2 q –1 |
| Приращение энтропии при обратимом процессе системы | D S = = DQ / T | джоуль на кельвин | Дж/К | L2 MT –2 q –1 |
| Удельная теплоемкость | c = = DQ /mDT | джоуль на килограмм кельвин | Дж/(кг.К) | L2 T –2 q –1 |
| Удельная энтропия | s = S / m | джоуль на килограмм кельвин | Дж/кг.К | L2 T –2 q –1 |
| Удельная теплота фазового превращения | q = Q / m | джоуль на килограмм | Дж/кг | L2 T –2 |
| Модуль градиента температуры | I grad T I = = D T / D l | кельвин на метр | К/м | L–1q |
| Продолжение табл.11 | ||||
| Тепловой поток | Ф =D Q /D t | ватт | Вт | L2 M T –3 |
| Плотность теплового потока | q = Ф / S | ватт на квадратный метр | Вт/м2 | M T –3 |
| Теплопроводность | l = = 
| ватт на метр кельвин | Вт/(м К) | L MT –3 q –1 |
| Температуро–проводность | a = l /cr | квадратный метр в секунду | м2/с | L2 T –1 |
| Коэффициент теплообмена | a = F/ S DT | ватт на квадратный метр - кельвин | Вт/(м2К) | MT –3 q –1 |
Таблица 12
| Величина | Единица и ее связь с единицами СИ |
| Количество теплоты | 1кал = 4,19 Дж |
| Теплоемкость системы; энтропия системы | 1 кал / К = 4,19 Дж/К |
| Удельная теплоемкость; удельная энтропия | 1кал / (г К) = 4,19 . 103 Дж / (кг.К) |
| Удельная теплота фазового превращения | 1 кал / г = 4,19.103 Дж/кг |
| Тепловой поток | 1 кал / с = 4,19 Вт |
| Плотность теплового потока | 1кал / (с см2) = 4,19 104 Вт / м2 |
| Теплопроводность | 1кал /(с см К) = 4,19.102 Вт / (м К) |
Основные формулы
Идеальные газы подчиняются уравнению состояния  , где р - давление газа, V - его объем, Т – термодинамическая температура, m –масса газа, М - молярная масса газа, R = 8,31441 Дж /(моль . К ) - газовая постоянная; отношение n = m / M дает количество газа.
, где р - давление газа, V - его объем, Т – термодинамическая температура, m –масса газа, М - молярная масса газа, R = 8,31441 Дж /(моль . К ) - газовая постоянная; отношение n = m / M дает количество газа.
По закону Дальтона давление смеси газов равно сумме их парциальных давлений, т.е. тех давлений, которые имел бы каждый из газов в отдельности, если бы он при данной температуре один заполнял весь объем.
Основное уравнение кинетической теории газов имеет вид
 ,
,
где n - число молекул в единице объема,  -средняя кинетическая энергия поступательного движения одной молекулы, m0 - масса молекулы,
-средняя кинетическая энергия поступательного движения одной молекулы, m0 - масса молекулы,  – средняя квадратичная скорость молекул. Эти величины определяются следующими формулами: число молекул в единице объема
– средняя квадратичная скорость молекул. Эти величины определяются следующими формулами: число молекул в единице объема  , где k = R / NA = 1,380662.10-23 Дж/К – постоянная Больцмана, NA = 6,022045 . 1023 моль-1 - постоянная Авогадро; средняя кинетическая энергия поступательного движения одной молекулы
, где k = R / NA = 1,380662.10-23 Дж/К – постоянная Больцмана, NA = 6,022045 . 1023 моль-1 - постоянная Авогадро; средняя кинетическая энергия поступательного движения одной молекулы  , средняя квадратичная скорость молекул
, средняя квадратичная скорость молекул  , причем m0 = M/ NA.
, причем m0 = M/ NA.
Внутренняя энергия газа  , где i - число степеней свободы молекул.
, где i - число степеней свободы молекул.
Связь между молярной С и удельной с теплоемкостями следует из определения: С = М с. Молярная теплоемкость газа при постоянном объеме  ; молярная теплоемкость при постоянном давлении Cp =CV R. Отсюда следует, что молярная теплоемкость С определяется числом степеней свободы i молекул газа:
; молярная теплоемкость при постоянном давлении Cp =CV R. Отсюда следует, что молярная теплоемкость С определяется числом степеней свободы i молекул газа:
– для одноатомного газа (i = 3) CV = 12,5 Дж / (моль . К), Ср = 20,8 Дж/(моль.К);
– для двухатомного газа (i = 5) CV = 20,8 Дж / (моль . К), Ср = 29,1 Дж/(моль.К);
– для многоатомного газа CV = 24,9 Дж/ (моль . К), Ср = 33,2 Дж / (моль . К).
Закон распределения молекул по скоростям (закон Максвелла) позволяет найти число молекул D N, относительные скорости которых лежат в интервале от u до u + D u:  . Здесь u = u ¤ uв – относительная скорость, u - данная скорость и uв =
. Здесь u = u ¤ uв – относительная скорость, u - данная скорость и uв =  – наиболее вероятная скорость молекул, Du-интервал относительных скоростей, малый по сравнению со скоростью u.
– наиболее вероятная скорость молекул, Du-интервал относительных скоростей, малый по сравнению со скоростью u.
При решении задач на закон распределения молекул по скоростям удобно пользоваться табл.13 , в которой даны значения D N /(ND u) для различных u.
Таблица 13
| u | DN /(ND u) | u | D N/(N D u) | u | D N /(N D u) |
| 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 | 0,02 0,09 0,18 0,31 0,44 0,57 0,68 0,76 | 0,9 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 | 0,81 0,83 0,82 0,78 0,71 0,63 0,54 0,46 0,36 | 1,8 1,9 2,0 2,1 2,2 2,3 2,4 2,5 | 0,29 0,22 0,16 1,12 0,09 0,06 0,04 0,03 |
Средняя арифметическая скорость молекул  .
.
Во многих случаях важно знать число молекул Nx, скорости которых превышают заданное значение скорости u. В табл.14 даны значения Nx / N для различных u, где N – общее число молекул.
Таблица 14
| u | Nx / N | u | Nx / N | u | Nx / N |
| 0,2 0,4 0,5 | 1,000 0,994 0,957 0,918 | 0,6 0,7 0,8 1,0 | 0,868 0,806 0,734 0,572 | 1,25 1,5 2,0 2,5 | 0,374 0,213 0,046 0,0057 |
Барометрическая формула дает закон убывания давления газа с высотой в поле силы тяжести:  . Здесь р -давление газа на высоте h, p0 - давление на высоте h = 0, g = 9,80665 м/с2 – ускорение свободного падения. Эта формула приближенная, так как получена в предположении, что Т не зависит от h.
. Здесь р -давление газа на высоте h, p0 - давление на высоте h = 0, g = 9,80665 м/с2 – ускорение свободного падения. Эта формула приближенная, так как получена в предположении, что Т не зависит от h.
Средняя длина свободного пробега молекул газа

где d - эффективный диаметр молекулы, n -число молекул в единице объема (концентрация молекул). Общее число столкновений всех молекул в единице объема за единицу времени  .
.
Масса, перенесенная за время D t при диффузии.
 ,
,
где D r /D x -градиент плотности в направлении, перпендикулярном к площадке D S, D = < u > l /3 -коэффициент диффузии (< u > -средняя арифметическая скорость, l -средняя длина свободного пробега молекул).
Сила внутреннего трения Fтр в газе:
 ,
,
где D u /D x -градиент скорости течения газа в направлении, перпендикулярном к площадке D S, h = áuñ lr CV ¤ 3 -динамическая вязкость.
Количество теплоты, перенесенное за время D t вследствие теплопроводности, определяется формулой  где D Т /D x -градиент температуры в направлении, перпендикулярном к площадке D S, À = á u ñ l r ¤ 3 - теплопроводность.
где D Т /D x -градиент температуры в направлении, перпендикулярном к площадке D S, À = á u ñ l r ¤ 3 - теплопроводность.
Первое начало термодинамики может быть записано в виде
d Q = d U + d A,
где d Q - количество теплоты, полученное газом, d U-приращение внутренней энергии газа, d A = p d V - работа, совершаемая газом. Внутренняя энергия газа
 ,
,
где Т - термодинамическая температура. Работа, совершаемая газом,  . Работа, совершаемая при изотермическом процессе,
. Работа, совершаемая при изотермическом процессе,
 .
.
Давление и объем газа связаны при адиабатическом процессе уравнением Пуассона pV g = const, где показатель адиабаты g = Cp /CV. Уравнение Пуассона может быть записано еще в таком виде: T V g = const,
Работа, совершаемая при адиабатическом процессе, может быть найдена по формуле
 ,
,
где p1 и V1 -давление и объем газа при температуре Т1.
Уравнение политропического процесса имеет вид p V n = const, где n – показатель политропы (0 < n < ¥).
Коэффициент полезного действия (КПД) тепловой машины
 ,
,
где Q1 – количество теплоты, полученное рабочим телом от нагревателя, Q2 – количество теплоты, отданное холодильнику. Для цикла Карно
 ,
,
где Т1 и Т2 – термодинамические температуры нагревателя и холодильника.
Разность энтропий SB – SA двух состояний В и А определяется формулой
 .
.
Реальные газы
Уравнение состояния реальных газов (уравнение Ван-дер-Ваальса) для одного моля газа имеет вид
 ,
,
где VM – молярный объем газа, а и b – постоянные, различные для разных газов, р – давление, Т – термодинамическая температура, R = 8,31411 Дж /(моль К) – газовая постоянная.
Уравнение Ван-дер-Ваальса для произвольной массы m газа имеет вид
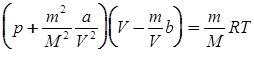 ,
,
где V -объем газа, М - молярная масса газа. В этом уравнении  – давление, обусловленное силами взаимодействия молекул,
– давление, обусловленное силами взаимодействия молекул,  – объем, связанный с собственным объемом молекул.
– объем, связанный с собственным объемом молекул.
Постоянные а и b данного газа связаны с его критической температурой Тк, критическим давлением pк и критическим молярным объемом VМk соотношениями
 .
.
Эти уравнения можно решить относительно постоянных а и b:
 .
.
Если ввести относительные величины r = T / TK, p = p / pk, w = VM / VMk ,
то уравнение Ван-дер-Ваальса для одного моля газа примет вид
 .
.
Примеры решения задач по молекулярной физике и термодинамике
1. Сколько молекул содержится в 1 м3 воды? Какова масса молекул воды? Считая, что молекулы воды имеют вид шариков, соприкасающихся друг с другом, найти диаметр d молекул.
Решение. Число N молекул, содержащихся в некоторой массе m , равно произведению числа Авогадро NA на количество вещества n: N = n NA. Так как количество вещества n = m /m1 , где m - молярная масса, то

Выразив в этой формуле массу как произведение плотности на объем V, получим
 (1)
(1)
Подставим в формулу (1) следующие значения величин: r= 103 кг/м3 ; V = 1 мм3 = 10-9 м3; М = 18 . 10 – 3 кг/моль; NA = 6,02 . 1023 моль-1 и произведем вычисления:  молекул = 3,34 . 1019 молекул.
молекул = 3,34 . 1019 молекул.
Массу m1 одной молекулы можно найти делением молярной массы на число Авогадро:  . Подставив сюда числовые значения М и N , найдем массу молекулы воды:
. Подставив сюда числовые значения М и N , найдем массу молекулы воды:  кг = 2,99 . 10 – 26 кг.
кг = 2,99 . 10 – 26 кг.
Если молекулы воды плотно прилегают друг к другу, то можно считать, что на каждую молекулу приходится объем (кубическая ячейка) V1 = d3 , где d - диаметр молекулы. Отсюда
 (2)
(2)
Объем V1 найдем, разделив молярный объем Vm на число молекул в моле, т.е. на число Авогадро NA:  . Подставим полученное выражение V1 в формулу (2):
. Подставим полученное выражение V1 в формулу (2):  . Входящий в эту формулу молярный объем определяется выражением
. Входящий в эту формулу молярный объем определяется выражением  . Тогда искомый диаметр молекулы
. Тогда искомый диаметр молекулы
 . (3)
. (3)
Проверим, дает ли правая часть выражения (3) единицу длины:

Теперь подставим числовые значения физических величин в формулу (3) и произведем вычисления:
 м = 3,11 . 10-10 м = 311 пм.
м = 3,11 . 10-10 м = 311 пм.
 молекул = 3,34 . 1028 молекул.
молекул = 3,34 . 1028 молекул.
2. Какое количество кислорода выпустили из баллона емкостью V = 10,0 л, если при этом показания манометра на баллоне изменились от 14,0 до 7,0 ат, а температура понизилась от t1 = 27 0С до t2 = 7 0С?
Решение. Масса выпущенного из баллона газа D m равна разности между начальной массой m1 кислорода в баллоне и его конечной массой m2:
D m = m1 – m2. (1)
Так как условия, при которых кислород находится в баллоне, не слишком сильно отличаются от нормальных, газ можно считать идеальным. Поэтому, воспользовавшись уравнением состояния идеального газа, запишем его для начального и конечного состояний газа в баллоне:
 . (2)
. (2)
Из уравнений (1) и (2) получим
 . (3)
. (3)
Чтобы найти давления газа в баллоне р1 и р2, прибавим к показаниям манометра величину атмосферного давления, равную 1,0 ат.
Выразим в единицах СИ числовые значения величин, входящих в формулу (3): р1 = 14 . 9,8 . 104 Па, р2 = 7,0 . 9,8 . 104 Па, Т1 = 300 К, Т2 = 280 К, V = 1,00.10-2 м3, М = 0,032 кг/моль, R = 8,3 Дж/(моль К). Подставив эти значения в (3) и выполнив вычисление, найдем: D m = 9,5 . 10 – 2 кг = 95 г.
3. Найти молярную массу воздуха, считая, что он состоит по массе из одной части кислорода и трех частей азота ( m1 : m2 = 1 : 3 ).
Решение. Прежде всего уточним понятие молярной массы смеси газов. Свойствами идеального газа могут обладать не только химически однородные газы, но и газовые смеси. Чтобы применить уравнение состояния для газовой смеси, ей необходимо приписать некоторую, хотя и лишенную химического смысла, относительную молекулярную массу. Ее называют кажущейся относительной молекулярной массой. Масса смеси в граммах, численно равная ей, представляет собой молярную массу Мсм смеси. Таким образом, величину Мсм выбирают такой, чтобы она удовлетворяла уравнению газового состояния, записанному для смеси:
 . (1)
. (1)
Чтобы решить данную задачу, рассмотрим каждую из газовых компонент, заключенных в объеме смеси, и запишем для нее уравнение состояния:
 (2)
(2)
 . (3)
. (3)
Здесь р1 и р2 -парциальные давления каждой компоненты. Для смеси справедлив закон Дальтона ( 6 : 2 ):
р = р1 + р2. (4)
Складывая почленно равенства (2) и (3), получим с учетом (4)
 . (5)
. (5)
Сравнивая (1) и (5) и учитывая, что масса смеси m = m1 + m2, найдем
 , (6)
, (6)
откуда
 .
.
Подставив числовые значения величин в единицах СИ:
М1 = 0,032 кг/моль, М2 = 0,028 кг/моль - и учитывая соотношение m2 = 3 m1, получим
 = 0,029 кг/моль.
= 0,029 кг/моль.
4. 6,6 г водорода расширяются изобарически до удвоения объема. Найти изменение энтропии при этом расширении.
Решение. Изменение энтропии определяется по формуле:
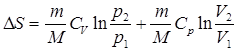 ;
;
При изобарическом процессе р1 = р2 и поэтому  .
.
Подставляя числовые данные задачи, получим D S = 66,3 Дж / К.
5. Сколько качаний n надо сделать, чтобы при помощи насоса, захватывающего при каждом качании V1 = 40 cм3 воздуха, наполнить камеру колеса велосипеда, имеющую объем V = 2000 см3, настолько, чтобы площадь ее соприкосновения с дорогой была S = 60 см2 при нагрузке на колесо F = 35 Н, если в начальный момент камера заполнена на  при нормальном атмосферном давлении?
при нормальном атмосферном давлении?
Решение. Наполнение камеры представляет собой изотермичекий процесс, подчиняющийся закону Бойля – Мариотта:
p0 V1 n = ( p0 + p ) ( V – V ’)
где ( V – V ’) -объем, занимаемый воздухом, закачиваемым насосом в процессе работы; V ’ -объем, который будет иметь при давлении ( р0 + р ) воздух, занимающий при нормальном давлении объем V0. Найдем объем V ’ из условия: p0 V0 = ( p0 + p ) V ’. Откуда:  Подставим это выражение в первое уравнение, получим:
Подставим это выражение в первое уравнение, получим:
p0 V1 n = ( p0 + p ) ( V - 0,75  ).
).
Откуда: n =  По условию задачи
По условию задачи  , поэтому
, поэтому  . Подставляя численные значения:
. Подставляя численные значения:
 .
.
6. Сколькими ходами n поршневого насоса емкостью V0 = 400 cм3 можно откачать воздух из баллона с объемом V = 1 л до давления pn = 0,76 мм рт. ст., если первоначальное давление в баллоне равно р0 = 760 мм рт. ст.?
Решение. Процесс откачивания воздуха происходит изотермически. На основании закона Бойля-Мариотта после 1–го хода поршня можно записать:
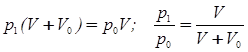 .
.
После 2–го хода поршня : p1V = p2 ( V + V0 ). Отсюда возьмем отношение:  . Перемножив 1–е и 2–е отношения, получим:
. Перемножив 1–е и 2–е отношения, получим:

После n ходов поршня: 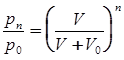 . Откуда следует:
. Откуда следует:  ;
;  . Подставив численные значения, получаем:
. Подставив численные значения, получаем:
 .
.
7. Вычислить удельные теплоемкости при постоянном объеме Cv и постоянном давлении Ср аргона и азота, принимая эти газы за идеальные.
Решение. Удельные теплоемкости идеальных газов выражаются формулами:
 и
и  ,
,
где i - число степеней свободы молекулы газа; М - молярная масса. Для одноатомного газа аргона i = 3 и М = 40 . 10 – 3 кг /моль, поэтому:
 Дж/кг К = 3,12 . 10 2 Дж /(кг К),
Дж/кг К = 3,12 . 10 2 Дж /(кг К),
 Дж /кг К = 5,2 . 10 2 Дж /(кг К).
Дж /кг К = 5,2 . 10 2 Дж /(кг К).
Для двухатомного газа азота i = 5 и М = 28 . 10 – 3 кг/моль, поэтому:
 Дж /кг К = 7,4 . 102 Дж /(кг К),
Дж /кг К = 7,4 . 102 Дж /(кг К),
 Дж/кг К = 1,04 . 102 Дж /(кг К).
Дж/кг К = 1,04 . 102 Дж /(кг К).
8. Кислород массы m = 2 кг занимает объем V1 = 1 м 3 и находится под давлением р1 = 0,2 мПа. Газ был нагрет сначала при постоянном давлении до объема V2 = 3 м 3, а затем при постоянном объеме до давления р3 = 0,5 мПа. Найти изменение D U внутренней энергии газа, совершенную им работу А и теплоту Q, переданную газу.
Решение. Изменение внутренней энергии газа выражается формулой
 , (1)
, (1)
где i – число степеней свободы молекул газа (для двухатомных молекул кислорода i = 5); М – молярная масса.
Начальную и конечную температуру газа найдем из уравнения Клапейрона – Менделеева  :
:
 . (2)
. (2)
Выпишем заданные величины в единицах СИ: m = 2 кг, М = 32 . 10-3 кг/моль, R = 8,31 Дж /(моль . К), V1 = 1 м 3, V 2 = V3 = 3 м3, р1 = р2 = 0,2 МПа, р3 = 0,5 мПа = 5 . 105 Па. Подставляя эти значения в выражение (2) и выполняя арифметические действия, получим:
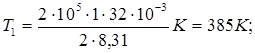
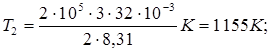
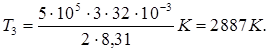
Подставляя в выражение (1) числовые значения величин, входящих в него, и выполняя арифметические действия, находим
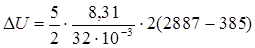 Дж = 3,24 . 106 Дж – 3,24 МДж.
Дж = 3,24 . 106 Дж – 3,24 МДж.
Работа при изобарном расширении газа выражается формулой:  . Подставив числовые значения величин, получим
. Подставив числовые значения величин, получим
 Дж = 0,400 . 106 Дж.
Дж = 0,400 . 106 Дж.
Работа газа, нагреваемого при постоянном объеме, равна нулю, т.е. А2=0. Следовательно, полная работа, совершенная газом, равна
А = А1 + А2 = 0,4 . 106 Дж.
Согласно первому началу термодинамики, теплота Q переданная газу, равна сумме изменения внутренней энергии DU и работы А: Q=DU+A, следовательно, Q = 0,4 . 106 Дж + 3,24.106 Дж = 3,64 . 106 Дж = 3,64 МДж.
9. 10 г кислорода находятся под давлением 3 . 105 Па при температуре 100С. После нагревания при постоянном давлении газ занял объем 10 л. Найти: 1) количество тепла, полученного газом; 2) энергию теплового движения молекул газа до и после нагревания.
Решение. Количество тепла, полученного газом, найдется по формуле 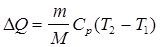 . Чтобы найти Т2, выпишем уравнения состояния газа до нагревания и после нагревания:
. Чтобы найти Т2, выпишем уравнения состояния газа до нагревания и после нагревания:  и
и  . Отсюда
. Отсюда  , но
, но  . Следовательно,
. Следовательно,
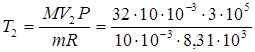 оК = 1156 оК.
оК = 1156 оК.
Таким образом, Т2 – Т1 = 1156 оК – 283 оК = 873 оК.
 Дж = 7,9 . 103 Дж.
Дж = 7,9 . 103 Дж.
Энергия газа до нагревания может быть найдена по формуле
 Дж.
Дж.
10. В цилиндре под поршнем находится водород массой m = 0,02 кг при температуре Т = 300 К. Водород сначала расширился адиабатически, увеличив свой объем в n1 = 5 раз, а затем был сжат изотермически, причем объем газа уменьшился в n2 = 5 раз. Найти температуру в конце адиабатического расширения и работу, совершенную газом при этих процессах.
Решение. Температуры и объемы газа, совершающего адиабатический процесс, связаны между собой соотношением
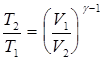 , или
, или  ,
,
где g – отношение теплоемкости газа при постоянном давлении и постоянном объеме (для водорода как двухатомного газа g = 1,4);  . Отсюда получаем следующее выражение для конечной температуры Т2:
. Отсюда получаем следующее выражение для конечной температуры Т2: 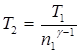 . Подставляя числовые значения заданных величин, находим
. Подставляя числовые значения заданных величин, находим  . Так как 5 0,4 = 1,91 (находится логарифмированием), то
. Так как 5 0,4 = 1,91 (находится логарифмированием), то  . Работа A1 газа при адиабатическом расширении может быть определена по формуле
. Работа A1 газа при адиабатическом расширении может быть определена по формуле
 ,
,
где СV – молярная теплоемкость газа при постоянном объеме.
Подставив числовые значения величин: R = 8,31 Дж/(моль . К), i = 5 (для водорода как двухатомного газа), М = 2 . 10 – 3 кг /моль, m = 0,02 кг, Т1 = 300 К, Т2 = 157 К в правую часть последней формулы и выполняя арифметические действия, получим
 Дж = 2,98 . 104 Дж.
Дж = 2,98 . 104 Дж.
Работа А2 газа при изотермическом процессе может быть выражена в виде  или
или  где n2 = V2 /V3 = 5.
где n2 = V2 /V3 = 5.
Подставляя известные числовые значения величин, входящих в правую часть этого равенства, и выполняя арифметические действия, находим:
 Дж = – 2 . 10 . 104 Дж.
Дж = – 2 . 10 . 104 Дж.
Знак “минус” показывает, что при сжатии работа газа совершается над газом внешними силами.
11. Идеальная тепловая машина, работающая по циклу Карно, получает за каждый цикл от нагревателя 600 калорий теплоты. Температура нагревателя 400 К, температура холодильника 300 К. Найти работу, совершаемую машиной за один цикл, и количество тепла, отдаваемого холодильнику за один цикл.
Решение. Тепловая машина , работающая по циклу Карно, совершает работу А, равную А = Q1 – Q2 = h Q1, где Q1 – количество тепла, получаемого машиной от нагревателя, Q2 – количество тепла, отданного холодильнику, h – КПД машины. Имеем  Тогда A = h Q1 = 150 кал= = 630 Дж. Далее Q2 = Q1 – A = 450 кал = 1880 Дж.
Тогда A = h Q1 = 150 кал= = 630 Дж. Далее Q2 = Q1 – A = 450 кал = 1880 Дж.