 |
|
Приклади розв’язування задач. Теплові явища
Задачі на теплові явища умовно можна поділити на три групи, але їх розв’язують на основі закону збереження і перетворення енергії для теплових процесів – першого закону термодинаміки. До першої групи віднесемо задачі, для розв’язування яких необхідно застосувати власне перший закон термодинаміки:  , де
, де  – робота, виконувана тілом.
– робота, виконувана тілом.
Задачі другої групи – це задачі, в яких, за умовою, кількість теплоти  , що надається тілу або тілам у процесі теплообміну з іншими тілами, які входять до замкненої системи, витрачається тільки на збільшення внутрішньої енергії цих тіл
, що надається тілу або тілам у процесі теплообміну з іншими тілами, які входять до замкненої системи, витрачається тільки на збільшення внутрішньої енергії цих тіл  (механічна робота з розширення або стиснення тіла чи тіл при цьому дорівнює нулю):
(механічна робота з розширення або стиснення тіла чи тіл при цьому дорівнює нулю):  .
.
У задачах третьої групи розглядається процес взаємодії тіл без теплообміну:  . Тоді перший закон термодинаміки набуває вигляду
. Тоді перший закон термодинаміки набуває вигляду 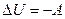 . Інакше, внутрішня енергія тіла (тіл) змінюється за рахунок роботи, що виконується цим тілом. Зміна внутрішньої енергії
. Інакше, внутрішня енергія тіла (тіл) змінюється за рахунок роботи, що виконується цим тілом. Зміна внутрішньої енергії  визначатиметься відповідно до процесів, що відбуваються з тілом: нагрівання (охолодження), пароутворення (конденсація), плавлення (кристалізація).
визначатиметься відповідно до процесів, що відбуваються з тілом: нагрівання (охолодження), пароутворення (конденсація), плавлення (кристалізація).
Задача 1. Газ, що здійснює цикл Карно, за рахунок кожних 2 кДж енергії, отриманої від нагрівника, виконує роботу 300 Дж. Який ККД цього циклу? У скільки разів абсолютна температура нагрівника більша від абсолютної температури холодильника?
Дано:
 , ,
 . .
| Розв’язування
Коефіцієнт корисної дії машини:
 ; ;  ; ;  .
Відношення абсолютної температури нагрівника .
Відношення абсолютної температури нагрівника 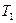 до абсолютної до абсолютної
|
  =? =?  =? =?
|
температури холодильника 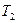 можна знайти, використавши вираз для ККД машини Карно:
можна знайти, використавши вираз для ККД машини Карно:
 .
.
Звідки:  ;
;  .
.
Відповідь:  ,
,  .
.
Задача 2. У посудину, де знаходилася маса  води і маса
води і маса  льоду при
льоду при  , впущено водяну пару, що має температуру
, впущено водяну пару, що має температуру 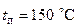 (за нормального тиску). Після того, як лід розстав, у посудині встановилася температура
(за нормального тиску). Після того, як лід розстав, у посудині встановилася температура  . Яку масу пари впущено у воду, якщо теплоємність посудини
. Яку масу пари впущено у воду, якщо теплоємність посудини  ? Питома теплоємність води
? Питома теплоємність води  , пари
, пари  ; питома теплота плавлення льоду
; питома теплота плавлення льоду  ; питома теплота пароутворення
; питома теплота пароутворення  .
.
Дано:
 , ,
 , ,
 = 273 К, = 273 К,
 = 423 К, = 423 К,
 = 303 К, = 303 К,
 , ,
 , ,
 , ,
 , ,
 . .
| Розв’язування
Кількість теплоти, що віддана парою під час її охолодження до температури конденсації (пароутворення),  . Кількість теплоти, що віддана парою під час її конденсації: . Кількість теплоти, що віддана парою під час її конденсації:  . Кількість теплоти, яка віддана сконденсованою водою під час її охолодження до температури . Кількість теплоти, яка віддана сконденсованою водою під час її охолодження до температури  , ,  . Кількість теплоти, отримана льодом під час його танення, . Кількість теплоти, отримана льодом під час його танення,  . Кількість теплоти, отримана водою, що є в посудині, і водою із льоду, що розтанув, під час її нагрівання до температури . Кількість теплоти, отримана водою, що є в посудині, і водою із льоду, що розтанув, під час її нагрівання до температури  , ,  . Кількість теплоти, отримана посудиною у процесі її нагрівання до температури . Кількість теплоти, отримана посудиною у процесі її нагрівання до температури  , ,  . Складаємо рівняння теплового балансу: . Складаємо рівняння теплового балансу:
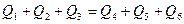 , ,
 Звідки знаходимо: Звідки знаходимо:
|
 =? =?
|

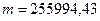 кг.
кг.
Відповідь:  = 255994,43 кг.
= 255994,43 кг.
Задача 3. Два молі ідеального газу нагрівають на 10 К так, що температура газу змінюється пропорційно квадрату тиску. Яку роботу виконує газ під час нагрівання?
Дано:
 , ,
 К. К.
| Розв’язування
Рівняння такого процесу можна записати у вигляді
 , (1)
де , (1)
де  – коефіцієнт пропорційності.
Робота, що виконується газом під час процесу, чисельно дорівнює площі під кривою залежності тиску газу від його об’єму. Виражаючи абсолютну температуру – коефіцієнт пропорційності.
Робота, що виконується газом під час процесу, чисельно дорівнює площі під кривою залежності тиску газу від його об’єму. Виражаючи абсолютну температуру 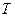 із рівняння стану ідеального газу: із рівняння стану ідеального газу:
| |

|
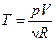
і, підставляючи її в рівняння процесу (1), отримуємо:
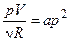 або
або 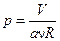
Тиск газу в заданому процесі пропорційний об’єму газу (мал. 6.10), тобто робота газу у разі зміни об’єму від 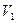 до
до 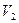 дорівнює площі трапеції (заштрихована область на рисунку). Тоді
дорівнює площі трапеції (заштрихована область на рисунку). Тоді
 ;
;
Із рівняння стану ідеального газу
 . (2)
. (2)
Підставивши рівняння (2) в рівняння процесу (1), одержимо:
 , звідки
, звідки 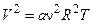 .
.
 ;
; 
Відповідь: А = 84 Дж.
Задача 4. Під дією зовнішніх сил об’єм і тиск ідеального одноатомного газу під час переходу зі стану 1 у стан 2 змінювались, як зображено на мал. 6.11. Визначити роботу зовнішніх сил, кількість теплоти, передану газу, і зміну внутрішньої енергії газу у цьому процесі.
Робота, що виконувалася над газом зовнішніми силами, дорівнює в одиницях pV площі трапеції під графіком процесу на мал. 6.11:
А = ﴾  ()V1 – V2 )
()V1 – V2 )
А = 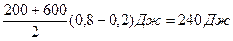
Обчислимо зміну внутрішньої енергії газу:
ΔU = U2 – U1,
ΔU= 
 ,
,
ΔU=  0,2 – 200·0,8) Дж=-40Дж.
0,2 – 200·0,8) Дж=-40Дж.
Знак мінус означає, що в стані 2 газ має меншу внутрішню енергію, ніж у стані 1. Згідно з першим законом термодинаміки кількість набутої теплоти дорівнює:
Q= ΔU-A,
Q=- 40 Дж- 240 Дж=-200Дж.
Вправа 12
1 (п). Під час ізотермічного розширення газ виконав роботу 20 Дж. Яку кількість теплоти надано газу?
2 (п). Під час адіабатного розширення азоту була виконана робота 500 Дж. Чому дорівнює зміна внутрішньої енергії азоту?
3 (п). Винахідник оголосив, що він сконструював машину, яка дає змогу від тонни вугілля одержати 9·1019 Дж енергії. Чи можна вірити цьому?
4 (д). Ідеальна теплова машина має ККД ŋ = 60%. У скільки разів кількість теплоти, що одержує робоче тіло від нагрівника, більша за кількість теплоти, що віддає робоче тіло холодильнику?
5 (д). У циліндрі компресора стискають 4 молі молекул ідеального одноатомного газу. Визначити зміну температури газу за один хід поршня, якщо при цьому виконано роботу 500 Дж. Процес вважати адіабатним.
6 (с). Яку роботу виконує молекулярний кисень масою 640 г під час його ізобарного нагрівання на 20 К?
7 (с). Температура нагрівника теплової машини 200 °С. Яка температура холодильника, якщо за рахунок 4 кДж енергії, що отримується від нагрівника, ідеальна машина виконує роботу 1,6 кДж?
8 (с). Наприкінці процесу стиснення газу в циліндрі карбюраторного двигуна внутрішнього згоряння тиск був 9·105 Па, а наприкінці процесу згоряння пального став 35·105 Па. Визначити температуру газу в циліндрі наприкінці процесу згоряння пального. Температура наприкінці процесу стиснення дорівнює 400 ºС. Поршень у процесі згоряння палива можна вважати нерухомим.
9 (с). В закритій посудині знаходиться 20 г азоту і 32 г кисню. Знайти зміну внутрішньої енергії суміші газів при охолодженні її на 28 К.
10 (в). Тіло масою  = 100 кг ковзає вниз по площині, що нахилена під кутом α = 30º до горизонту. Як зміниться внутрішня енергія тіла і похилої площини під час переміщення тіла на відстань
= 100 кг ковзає вниз по площині, що нахилена під кутом α = 30º до горизонту. Як зміниться внутрішня енергія тіла і похилої площини під час переміщення тіла на відстань 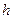 = 3,0 м по вертикалі? Коефіцієнт тертя ковзання μ = 0,2.
= 3,0 м по вертикалі? Коефіцієнт тертя ковзання μ = 0,2.
11 (в). Одноатомний ідеальний газ під час ізобарного нагрівання виконує роботу 8 кДж. Обчислити зміну внутрішньої енергії та кількість теплоти, що передали газу.
12 (в). Середня потужність домашнього холодильника 100 Вт. Яку кількість теплоти він виділяє у кімнату за добу, якщо його холодильний коефіцієнт ε = 9?
!Найголовніше у розділі 6
Усі закономірності термодинаміки стосуються термодинамічної системи в рівноважному стані. Тому поняття «термодинамічна система» (мал. 6.12) є головним у цьому розділі поряд із головним поняттям усієї частини «Молекулярна фізика і термодинаміка» – «температура».

Мал. 6.12
Будь-яка термодинамічна система має внутрішню енергію, яку можна змінити через підведення певної кількості теплоти або виконання роботи над системою. Кількісно ці величини поєднуються у першому законі термодинаміки. Цей закон може бути застосованим до ізохорного, ізобарного, ізотермічного та адіабатного процесів.
Багато процесів, цілком можливих з погляду закону збереження енергії, ніколи насправді не відбуваються. До них належать і оборотні процеси. Необоротність теплових процесів у природі виражає другий закон термодинаміки вказуванням напряму можливих енергетичних перетворень. Закони термодинаміки дали змогу людству знайти пристрій для перетворення теплової енергії в механічну – тепловий двигун. Розроблення теплових двигунів спиралося на теорію ідеального циклу Карно, а також одну з теорем Карно про максимальність ККД ідеальної машини і на цій основі підвищення ККД реальних теплових двигунів.
Значні досягнення має термодинаміка і в дослідженні внутрішньої структури речовини, адже, знаючи характер зміни теплових потоків, що пропускають через зразок матеріалу, можна робити певні висновки і про його внутрішню будову.
Відповіді до вправ
Р.І.
Вправа 2.3. 50 год. 4. 50с. 5. 73 км/год. 6. 25 км/год. 8. 2,5 м/с.
Вправа 3.4. 0,21 м/с2. 5. а = 0,25 м/с2. 6. s = 625 м. 7. 52 м/с.
Вправа 4.4.У 4 рази. 5. 7,65 м/с. 6. 0,8 м/с2. 7. 7,8 км/с ∙ 9,1 м/с2. 8. 5м; 15м; 25м. 9. 2170м.
Р.II.
Вправа 5.5. б. 6. рухаються з однаковою швидкістю.
Р.III.
Р.IV.
Р.V.
Вправа 9.1. μ = 18·10-3 кг/моль,  = 3,0·10-29 м3; ν = 55,6 моля;
= 3,0·10-29 м3; ν = 55,6 моля;  = 3,34·1028 молекул;
= 3,34·1028 молекул;  = 3,0·10-26 кг. 2. на 1,9·1019 молекул. 3. n = 5,8·10 27 м – 3 . 4.
= 3,0·10-26 кг. 2. на 1,9·1019 молекул. 3. n = 5,8·10 27 м – 3 . 4. 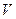 = 300 м3. 5.
= 300 м3. 5. 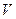 = 0, 57·10 – 7 м3. 6. N = 4·10 18 с - 1. 7. Т1 = 250 К. 8.
= 0, 57·10 – 7 м3. 6. N = 4·10 18 с - 1. 7. Т1 = 250 К. 8.  = 2,3·1022 частинок. 9. d ≈ 2,8·10 - 10 частинок. 10. N = 6,3·1019.
= 2,3·1022 частинок. 9. d ≈ 2,8·10 - 10 частинок. 10. N = 6,3·1019.
Вправа 10.1. <Е к> = 5·10 – 21 Дж. 2. <υ кв> = 1900 м / с. 3. 53,6 кПа. 4. 25∙10 27. 5. N = 5, 8 10 21 . 6.  = 0,8 м. 7. метан – CH4. 8. m1 = 5 г, m2 = 8 г 9. р = 1,41·105 Н/м2.
= 0,8 м. 7. метан – CH4. 8. m1 = 5 г, m2 = 8 г 9. р = 1,41·105 Н/м2.
Вправа 11.1. N = 4·1018 . 2. m = 1,8·10-2 кг. 3.  = 0,387 кг. 4. F ≈ 11·10-2 Н. 5.
= 0,387 кг. 4. F ≈ 11·10-2 Н. 5.  = 2,5 км/с. 6. P = 22,5 кВт. 7. τ ≈ 39 хв. 8. Ек = 11,46·10-3 Дж. 9.
= 2,5 км/с. 6. P = 22,5 кВт. 7. τ ≈ 39 хв. 8. Ек = 11,46·10-3 Дж. 9.  = 0,266·103 кг/м3. 10. σ = 0,018 Н/м. 11.
= 0,266·103 кг/м3. 10. σ = 0,018 Н/м. 11. 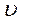 = 420 м/с. 12. F = 196·10-5 Н.
= 420 м/с. 12. F = 196·10-5 Н.
Р.VI.
Вправа 12.1. 20 Дж. 2. – 500 Дж. 3. у 2,5 рази. 4. Δ Т ≈ 10 К. 5. А = 332 Дж.
6. T2 = 284 К. 10.  = 1020 Дж. 11.
= 1020 Дж. 11.  = 12·103 Дж,
= 12·103 Дж,  = 2·104 Дж.
= 2·104 Дж.
12. Q = 8,6·107 Дж.
Віднести після розділу «Термодинаміка».
Зміст
Слово до учнів...2
Слово до вчителя...3
Вступ. Фізика у пізнанні речовини, поля, простору і часу...4
Механіка...7
Розділ 1. Основи кінематики...7
§ 1. Механічний рух...7
§ 2. Швидкість. Види руху...11
§ 3. Прискорення. Рівноприскорений рух...18
Лабораторна робота № 1. Визначення прискорення тіла в рівноприскореному русі...24
§ 4. Вільне падіння тіл. Прискорення вільного падіння тіл...25
§ 5. Криволінійний рух...28
§ 6. Рівномірний рух тіла по колу. Період і частота обертання. Кутова і лінійна швидкість. Доцентрове прискорення…30
§ 7. Як розв’язувати задачі з кінематики...34
Найголовніше у розділі 1... 35
Розділ 2. Динаміка…37
§ 8. Перший закон Ньютона...38
§ 9. Місце планети Земля та людини у всесвіті...44
§ 10. Взаємодія тіл. Сила. Види сил у механіці...47
§ 11. Взаємодія тіл. Сила пружності...51
Лабораторна робота № 2.Дослідження залежності видовження пружини від прикладеної до неї сили...54
§ 12. Другий закон Ньютона... 56
Лабораторна робота № 3.Дослідження рівноваги тіла під дією кількох сил...59
§ 13. Третій закон Ньютона. Межі застосування законів Ньютона...60
§ 14. Гравітаційна взаємодія. Закон всесвітнього тяжіння...62
§ 15. Поле тяжіння...64
§ 16. Як, використовуючи закони Ньютона, можна вивести формулу закону всесвітнього тяжіння...66
§ 17. Сила тяжіння. Вага тіла. Рух тіла під дією сили тяжіння...67
§ 18. Штучні супутники Землі...72
Найголовніше у розділі 2...74
Розділ 3. Закони збереження в механіці....76
§ 19. Імпульс. Закон збереження імпульсу...76
§ 20. Реактивний рух...80
§ 21. Механічна робота. Потужність...82
§ 22. Енергія. Закон збереження повної механічної енергії...82
Найголовніше у розділі 3...88
Розділ 4. Релятивістська механіка...89
§ 23. Релятивістська механіка. Постулати спеціальної теорії відносності...89
§ 24. Відносність часу...91
§ 25. Маса і імпульс в теорії відносності. Закон взаємозв'язку маси і енергії...92
Найголовніше у розділі 4...95
Молекулярна фізика і термодинаміка...96
Молекулярна фізика...96
Розділ 5. Властивості газів, рідин, твердих тіл...97
§ 26. Основні положення молекулярно-кінетичної теорії речовини...97
§ 27. Маса та розміри молекул...102
§ 28. Ідеальний газ. Основне рівняння молекулярно-кінетичної теорії ідеального газу...104
§ 29. Молекулярно-кінетичний зміст температури...107
§ 30. Швидкість молекул газу...110
§ 31. Рівняння стану ідеального газу (рівняння Клапейрона – Менделєєва)…111
§ 32. Газові закони для ізопроцесів...112
Лабораторна робота № 4.  Вивчення ізотермічного процесу...115
Вивчення ізотермічного процесу...115
§ 33. Приклади розв’язування задач. Газові закони...116
§ 34. Взаємні перетворення рідин і газів…120
§ 35. Поверхневий натяг рідин...127
§ 36. Будова і властивості твердих тіл. Рідкі кристали. Полімери…129
Лабораторна робота № 5. Вимірювання відносної вологості повітря...133
§ 37. Приклади розв’язування задач...133
Найголовніше у розділі 5...136
Розділ 6. Основи термодинаміки...138
§ 38. Внутрішня енергія тіла і способи її зміни...138
§ 39. Кількість теплоти. Питома теплоємність речовини...140
§ 40. Робота в термодинаміці...141
§ 41. Перший закон термодинаміки...142
§ 42. Теплові машини...145
§ 43. Застосування теплових машин і проблеми охорони навколишнього середовища...148
Лабораторна робота № 6.Вивчення принципу дії холодильної машини...149
§ 44. Приклади розв’язування задач. Теплові явища...150
Найголовніше у розділі 6...154
Відповіді до вправ...159
[1] Потенціальний – від лат. potentia – сила. Потенціальний – можливий, той, що існує в потенції.
[2] кінетичний – від грец. руховий, рухливий, той, що пов’язаний з рухом.
[3] Постулат (від лат. postulatum – вимога). У фізичній теорії відіграє ту саму роль, що аксіома у математиці. У фізиці постулат є результатом узагальнення дослідних фактів.
[4] 1) Усі ефекти, що є наслідком теорії відносності, часто називають релятивістськими.