 |
|
Будова і властивості твердих тіл. Рідкі кристали. Полімери
Кристалічні та аморфні тіла. Види деформацій. Модуль Юнга. Рідкі кристали та їх властивості. Полімери: їх властивості та застосування.
Кристалічні та аморфні тіла.Твердими називають такі тіла, які зберігають об’єм і форму навіть під час дії на них інших тіл (сил). Причиною такої стійкості є характер руху і взаємодії молекул: вони не можуть змінювати положення своєї рівноваги, здійснюючи малі коливання і обертаючись навколо нього. Енергія і амплітуда коливань тим більша, чим вища температура тіла.
За впорядкованістю молекул відносно положення рівноваги тверді тіла поділяють на кристалічнііаморфні. Кристалічні тіла відрізняються від аморфних своїми властивостями, зовнішнім видом і внутрішньою структурою.
Головна їх відмінність полягає у тому, що в них атоми або молекули розміщені впорядковано і утворюють періодично повторювану внутрішню структуру (дальній порядок). Можна виділити маленький об’єм (елементарну комірку), завдяки якій можна побудувати весь кристал, як будинок із цегли (мал. 5.39). Елементарна комірка (кристалічна ґратка) може мати форму куба, паралелепіпеда, призми тощо. Правильна геометрична форма є істотною зовнішньою ознакою будь-якого кристала в природних умовах (візерунки на вікнах під час морозу, правильні форми сніжинок, кристалів кухонної солі, гірського кришталю тощо). Однак, кристалічна ґратка не відображає ні взаємних відстаней частинок, ні їх відносних розмірів, але дає змогу легко уявити взаємне розташування центрів частинок у просторі. Насправді ж атоми, молекули та іони розташовані у кристалах щільно: вони дотикаються або навіть перекривають одне одного.
Кристали однієї і тієї самої речовини можуть мати різну форму, яка залежить від умов їх утворення; вони можуть відрізнятися і за кольором. Іноді увесь шматок твердої речовини може становити один кристал. Такими є, наприклад, шматочки цукру в цукровому піску, шматочки солі, гірського кришталю тощо. Усе це окремі кристали, їх називають монокристалами.
Особливостями кристалів є їх анізотропність, тобто неоднаковість фізичних властивостей у різних напрямах. Анізотропія механічних, теплових, електромагнітних і оптичних властивостей кристалів пояснюється тим, що за упорядкованого розміщення атомів, молекул або іонів сили взаємодії між ними і міжатомні відстані виявилися неоднаковими в різних напрямах.
Кристалічні тіла мають точку плавлення. Багато властивостей кристалів і передусім їх механічні та електричні властивості дуже чутливі до дефектів у кристалічних ґратках, а також наявності у них навіть мізерних кількостей домішок.
Дефекти реальних кристалів та їх структуру можна безпосередньо виявити за допомогою електронно-мікроскопічних і рентгенівських досліджень.
Кристали утворюються в природних умовах і штучно. За припущеннями вчених, у природних умовах багато кристалів утворилось внаслідок охолодження рідкої речовини земної кори – магми, що складається з різних розплавлених речовин. Деякі речовини можуть утворювати досить великі кристали (мал. 5. 40), інколи дуже правильної форми. Багато мінералів виникли з перенасичених водних розчинів. Першим серед них слід назвати кам’яну сіль NaCl. Товщина пластів кам’яної солі, що утворилися під час випаровування води солоних озер, досягає в деяких родовищах кількох сотень метрів.
Штучні кристали можна здобути з розплаву шляхом кристалізації з розчину і газу. Останнім часом швидкими темпами розвивається технологія вирощування монокристалів всіма відомими способами на космічних орбітальних станціях. Невагомість і космічний вакуум дають можливість вирощувати монокристали небачених раніше розмірів і хімічної чистоти.
Монокристали знайшли широке застосування в сучасній фізиці і техніці. Усі напівпровідникові прилади (діоди, транзистори) є кристалами зі спеціально введеними домішками. Виникла нова галузь електроніки – молекулярна електроніка. Монокристали є основною деталлю багатьох типів сучасних приладів, які дістали назву квантових підсилювачів і генераторів (мазерів і лазерів).
Аморфні тіла – це тіла, фізичні властивості яких однакові в всіх напрямах. Прикладами аморфних тіл є шматки затверділої смоли, бурштин, вироби зі скла, різні сорти гуми, віск тощо. Аморфні тіла ізотропні. За своєю будовою аморфні тіла нагадують дуже густі рідини. В аморфних тіл існує ближній порядоку розташуванні частинок речовини (мал. 5.41). У результаті підвищення температури час осілого життя молекул зменшується, тому аморфне тіло поступово м’якне. Аморфні тіла не мають температури плавлення і питомої теплоти плавлення. Вони, на відміну від кристалів з підвищенням температури, безперервно перетворюються в рідину.
Значна відмінність кристалічних тіл від аморфних виявляється в процесах плавлення і тверднення. Плавленням називають процес переходу речовини із твердого стану в рідкий. Зворотний процес переходу речовини із рідкого стану в твердий називають твердненням. Досліди показують, що кристалічні тіла плавляться і тверднуть за певної для кожної речовини температури, яку називають температурою плавлення. Під час нагрівання кристалічного тіла інтенсивність коливального руху молекул у кристалі підвищується, а з досягненням температури плавлення коливання стають такими інтенсивними, що молекули (атоми) вже не можуть утриматися у вузлах ґратки і вони руйнуються – відбувається плавлення. Для кожного кристалічного тіла температура плавлення своя.
Графік залежності температури 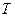 кристалічного тіла від наданої йому (або відібраної) кількості теплоти зображено на мал. 5.42. Ділянка АВ графіка відповідає твердому стану речовини і показує, що під час нагрівання (або охолодження) температура твердого тіла змінюється. Точка В відповідає температурі плавлення
кристалічного тіла від наданої йому (або відібраної) кількості теплоти зображено на мал. 5.42. Ділянка АВ графіка відповідає твердому стану речовини і показує, що під час нагрівання (або охолодження) температура твердого тіла змінюється. Точка В відповідає температурі плавлення  , з досягненням якої під час нагрівання тіло починає плавитися. Ділянка ВС графіка відповідає процесу плавлення (або тверднення) тіла, під час якого тіло існує частково в рідкому, частково в твердому стані. Температура тіла при цьому не змінюється. Уся кількість теплоти витрачається тільки на збільшення потенціальної енергії молекул тіла, а їх кінетична енергія не змінюється. Тому не змінюється і температура – міра середньої кінетичної енергії молекул.
, з досягненням якої під час нагрівання тіло починає плавитися. Ділянка ВС графіка відповідає процесу плавлення (або тверднення) тіла, під час якого тіло існує частково в рідкому, частково в твердому стані. Температура тіла при цьому не змінюється. Уся кількість теплоти витрачається тільки на збільшення потенціальної енергії молекул тіла, а їх кінетична енергія не змінюється. Тому не змінюється і температура – міра середньої кінетичної енергії молекул.
Збільшення потенціальної енергії молекул призводить до руйнування кристалічних ґраток тіла, тобто до зміни агрегатного стану речовини.
Точка С відповідає повному переходу тіла в рідину під час плавлення (або початку тверднення рідини під час її охолодження). Ділянка СД графіка відповідає рідкому стану речовини і показує, що під час нагрівання (або охолодження) температура рідини змінюється.
Спостереження показують, що температура плавлення залежить від тиску. Якщо плавлення речовини супроводжується збільшенням її об’єму (що спостерігається у більшості речовин), то зі збільшенням зовнішнього тиску температура плавлення цієї речовини підвищується. Якщо ж плавлення речовини супроводжується зменшенням його об’єму (наприклад, льоду, чавуну, вісмуту, сурми), то під час підвищення зовнішнього тиску температура плавлення цієї речовини знижується.
Аморфні тіла не мають певної температури плавлення або тверднення. У процесі плавлення (або тверднення) температура аморфних тіл безперервно змінюється (мал. 5.43).
Друга особливість аморфних тіл – це їх пластичність, тобто вони не мають межі пружності. Аморфний стан нестійкий: через деякий час аморфна речовина переходить у кристалічний стан. Але часто цей час буває дуже тривалим (роки і десятиріччя). До таких тіл належить скло. Прозорість якого зменшується через багто років (воно мутніє): у ньому утворюються дрібні кристалики силікатів. За низьких температур властивості аморфних тіл більш близькі до кристалічних тіл, а за високих – до рідин. Подібно до кристалічних тіл аморфні тіла стають дещо пружними, а подібно до рідин вони здатні текти.
Швидко розвивається вивчення, виготовлення і технічне використання аморфних металів, які дістають над швидким охолодженням струмини чи крапель розплаву металу. У них високими є міцність і твердість, унікальні магнітні та інші властивості.
Нині широкого застосування набули композити.Їх вважають третім видом твердої речовини. Атоми і молекули у композитах розташовуються впорядковано в певній частині трьохвимірного простору, але цей порядок не повторюється з регулярною періодичністю. Композити (дерево, залізобетон, цегла, кістки, судини, склопластик, вуглецеві композити) складаються з різних, пов’язаних між собою матеріалів.
Рідкі кристали та їх властивості.Крім аморфного, відкрито ще один стан речовини з подвійною природою – і рідини, і твердого тіла – це так звані рідкі кристали, особливий стан деяких органічних речовин. Для них характерна плинність і вони утворюють краплі. Однак їх краплі можуть мати не кулеподібну, а видовжену овальну форму. Оскільки бокова взаємодія таких молекул значно перевищує взаємодію їх кінців, вони певним чином упорядковуються. Молекули у краплі розміщуються у порядку, не властивому звичайним рідинам і твердим тілам. Якщо в твердих кристалах спостерігається дальній порядок розміщення частинок у трьох взаємно перпендикулярних напрямах, то в рідких – за одним напрямом (одновісний дальній порядок). Анізотропія рідких кристалів виявляється в оптичних властивостях, їх залежності від температури, сили струму тощо. У рідких кристалів анізотропними є також поверхневий натяг, електропровідність, діелектрична і магнітна проникності. За механічними властивостями вони нагадують рідини, в’язкість яких коливається від рідкого клею до «твердого» скла.
Існують рідкі кристали в певному інтервалі температур, різному для різних речовин. Під час нагрівання вони перетворюються в звичайну рідину, внаслідок охолодження стають твердими кристалами. Температури переходу із твердого в рідкокристалічний стан різні, від -20 до +400 ºС.
Дотепер вивчено понад 3000 речовин, що утворюють рідкі кристали. До них належать речовини біологічного походження, наприклад, дезоксирибонуклеїнова кислота, що несе код спадкової інформації, речовина мозку, мембрани клітин, віруси тощо. Подальші дослідження цих речовин не тільки розширять їх застосування в техніці, але й допоможуть проникнути в таємниці біологічних процесів.
Рідкокристалічні пристрої з великою кількістю елементів і складною електронною схемою керування слугують телевізійними екранами, дисплеями обчислювальної техніки, букво-цифровими індикаторами та іншими приладами.
? Запитання для самоперевірки
1. Чим відрізняються кристалічні тіла від аморфних?
2. Назвіть основні властивості кристалічних тіл.
3. Які основні властивості аморфних тіл?
4. Що називають монокристалом?
5. Які тіла називають полікристалічними?
6. Що таке анізотропія? Ізотропність?
7. Наведіть приклади монокристалічних, полікристалічних і аморфних тіл.
8. Чому протягом усього часу плавлення температура кристалічного тіла не змінюється?
9. Чому аморфні тіла не мають визначеної температури плавлення?