 |
|
Поверхневий натяг рідин
Сила поверхневого натягу. Змочування. Капілярні явища
Сила поверхневого натягу.Будь-яка хімічно однорідна речовина може бути за одних умов у газоподібному стані, а за інших – у рідкому. Водночас за своїми властивостями гази і рідини істотно відрізняються. Рідини, як і гази, не мають певної форми і набувають форми тієї посудини, в якій знаходяться, але газ не має власного об’єму 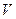 і займає будь-який наданий йому об’єм. Об’єм рідини – сталий. Газ відносно легко стискається, а рідини майже нестисливі. Можливість вільного переміщення молекул рідини одна відносно одної зумовлює їх плинність.
і займає будь-який наданий йому об’єм. Об’єм рідини – сталий. Газ відносно легко стискається, а рідини майже нестисливі. Можливість вільного переміщення молекул рідини одна відносно одної зумовлює їх плинність.
Найхарактернішою властивістю рідини, що відрізняє її від газу, є те, що на межі з газом рідина утворює вільну поверхню. На кожну молекулу рідини діють сили притягання сусідніх молекул. Ці сили для молекул, що знаходяться всередині рідини, взаємно скомпенсовані (мал. 5. 36). Рівнодійна ж сил притягання, що діє на молекули, які знаходяться на поверхні розділу, напрямлена вниз (усередину рідини).Молекули поверхневого шару, товщина якого дорівнює радіусу дії молекулярних сил, чинять молекулярний тиск на рідину, стягуючи її поверхню до мінімуму. Це явище називається явищем поверхневого натягу. Завдяки поверхневому натягу води на її поверхні можуть утримуватися легкі (навіть металеві – змащене жиром лезо) предмети і рухатися комахи-водомірки.
Поверхневий шар рідини розтягнутий і між молекулами на поверхні діють сили притягання, рівнодійну яких називають силою поверхневого натягу. Вона направлена перпендикулярно до будь-якого елемента лінії, проведеної на поверхні, по дотичній до поверхні рідини.
Під дією сил поверхневого натягу поверхневий шар рідини намагається скоротити площу своєї поверхні до мінімальних розмірів, можливих при певному об’ємі рідини. Мінімальну поверхню серед тіл певного об’єму має куля. Тому за відсутності (або дуже малої) дії сил рідина набуває форми кулі.
Для кількісного оцінювання сили поверхневого натягу її відносять до одиниці довжини межі поверхневого шару. Нехай l – довжина лінії, вздовж якої обмежена поверхня розділу рідини, стінок посудини, в якій вона знаходиться, і повітря з парами рідини, тоді коефіцієнт поверхневого натягу дорівнює відношенню сили поверхневого натягу 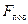 до довжини лінії l, що обмежує поверхню розділу і вздовж якої вона діє по дотичній в кожній точці, перпендикулярно до будь-якого елемента лінії розділу середовищ:
до довжини лінії l, що обмежує поверхню розділу і вздовж якої вона діє по дотичній в кожній точці, перпендикулярно до будь-якого елемента лінії розділу середовищ:
 (5. 15)
(5. 15)
У СІ [σ] = Н/м.
Цей коефіцієнт, визначений для багатьох однорідних рідин і занесений до таблиць, не залежить від довжини контуру, а визначається фізичними властивостями рідини, її станом. У результаті підвищення температури коефіцієнт 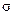 зменшується через збільшення середньої відстані між молекулами на поверхні рідини. За критичної для певної рідини температури її поверхневий натяг дорівнює нулю. На значення коефіцієнта
зменшується через збільшення середньої відстані між молекулами на поверхні рідини. За критичної для певної рідини температури її поверхневий натяг дорівнює нулю. На значення коефіцієнта 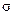 також впливає наявність домішок у самій рідині. Зокрема, мило зменшує коефіцієнт поверхневого натягу води з 72·10 – 3 до 45·10 – 3 Н/м. У процесі прання білизни значення
також впливає наявність домішок у самій рідині. Зокрема, мило зменшує коефіцієнт поверхневого натягу води з 72·10 – 3 до 45·10 – 3 Н/м. У процесі прання білизни значення 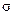 зменшується як через нагрівання рідини, так і в результаті введення мийних засобів, що сприяє легшому проникненню розчину у тканину. Бензин і різні спирти застосовують під час хімічного чищення одягу.
зменшується як через нагрівання рідини, так і в результаті введення мийних засобів, що сприяє легшому проникненню розчину у тканину. Бензин і різні спирти застосовують під час хімічного чищення одягу.
Змочування.Якщо рідина межує з її парою, то взаємодії між молекулами слабкіші і їх можна не враховувати. Коли поверхневий шар рідини межує з твердим тілом, то взаємодію молекул рідини і твердого тіла слід враховувати. У повсякденному житті можна спостерігати, що крапля води розпливається по чистій поверхні скла (мал. 5.37, а), але не розпливається по забрудненій жиром поверхні і має при цьому форму майже правильної кулі (мал. 5.37, б). У першому випадку кажуть, що вода змочує поверхню, у іншому – не змочує.
Якщо взаємодія молекул рідини менша, ніж їх взаємодія з молекулами контактного твердого тіла, то маємо випадок змочування і навпаки, коли ця взаємодія більша, – незмочування.
Явища змочування і незмочування відіграють важливу роль у побуті і техніці. Якби вода не змочувала тіло людини, то марним було б купання. Добре змочування потрібне під час фарбування і прання, паяння, збагачення руд цінних порід та інших технічних процесів.
Так, розчин мила допомагає відмити забруднені руки. Молекули мила складаються з «активної» частини, що сильно взаємодіє з водою, і з вуглеводневого ланцюга атомів, які з водою взаємодіють слабо. Молекули мила концентруються на поверхні, що відмивається, і орієнтуються активними кінцями до води. Тому поверхня тіла краще змочується водою. Вода розпливається по поверхні тіла, витісняючи з неї частинки бруду.
Капілярні явища. Змочування або незмочування рідиною стінок посудини впливає на форму вільної поверхні рідини у посудині а тако ж призводить до підняття або опускання рідини в них відносно рівня рідини у посудині, в яку занурено капіляр. Ці явища називаються капілярними. Як саме пояснити капілярні явища?
Опустимо в рідину густиною ρ циліндричний капіляр радіусом  ≈ 1 мм (мал. 5.38). Підняття рідини в капілярі припиниться тоді, коли сила тяжіння піднятого стовпа рідини зрівноважить рівнодійну сил поверхневого натягу:
≈ 1 мм (мал. 5.38). Підняття рідини в капілярі припиниться тоді, коли сила тяжіння піднятого стовпа рідини зрівноважить рівнодійну сил поверхневого натягу:
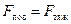 . (5.16)
. (5.16)
Сила поверхневого натягу 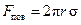 . Сила тяжіння
. Сила тяжіння 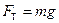 . Оскільки
. Оскільки 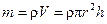 , рівність (5.26) набуде вигляду:
, рівність (5.26) набуде вигляду:
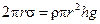 . (5.17)
. (5.17)
Із рівності (5.17) знаходимо висоту підняття рідини для циліндричного капіляра:
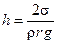 ,
,
де 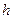 – висота підняття рідини в циліндричному капілярі; σ – коефіцієнт поверхневого натягу рідини; ρ – густина рідини;
– висота підняття рідини в циліндричному капілярі; σ – коефіцієнт поверхневого натягу рідини; ρ – густина рідини;  – радіус капіляра;
– радіус капіляра; 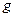 – прискорення вільного падіння.
– прискорення вільного падіння.
Якщо рідина не змочує капіляр, то в цьому разі рівень рідини у ньому буде нижчим від рівня рідини у посудині. Різниця цих рівнів, яку також позначають через 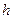 , має таку саму залежність від σ, ρ і
, має таку саму залежність від σ, ρ і  , як і у разі змочування.
, як і у разі змочування.
Капілярні явища мають велике значення в природі і техніці. Завдяки цим явищам відбувається проникнення вологи з ґрунту в стебла і листя рослин. Саме в капілярах відбуваються основні процеси, пов’язані з диханням і живленням організмів. У тілі дорослої людини приблизно 160·109 капілярів, загальна довжина яких сягає 60 – 80 тис. км.
У будівництві враховують можливість підняття вологи по капілярних порах будівельних матеріалів. Для захисту фундаменту і стін від дії ґрунтових вод та вологи застосовують гідроізоляційні матеріали: толь, смоли тощо.
Завдяки капілярному підняттю вдається фарбувати тканини. Часто капілярні явища використовують і в побуті. Застосування рушників, серветок, гігроскопічної вати, марлі, промокального паперу можливе завдяки наявності в них капілярів.
? Запитання для самоперевірки
1. Які властивості має поверхневий шар рідини?
2. Що називають поверхневим натягом?
3. Виконавши рисунок, установіть фізичний зміст поверхневого натягу як величини, пов’язаної з енергією поверхневого шару рідини.
4. Наведіть приклади дії сил поверхневого натягу.
5. Що називають коефіцієнтом поверхневого натягу? Від чого він залежить? У яких одиницях вимірюється коефіцієнт поверхневого натягу в СІ?
6. Що таке сила поверхневого натягу? Яка формула виражає зміст цього поняття?
7. Як зміниться сила поверхневого натягу води у разі розчинення в ній мила?
8. Якої форми набувають краплі рідини в умовах невагомості? Чому?
9. Виконавши пояснювальний рисунок, розкрийте фізичну сутність явищ змочування і незмочування.
10. Чому плями із жиру на одязі не вдається змити водою?
11. Що називають капілярністю?
12. Обґрунтуйте, в якому випадку рідина у капілярі піднімається, а в якому – опускається.
13. Чому фундамент цегляних будинків покривають гарячим бітумом чи обкладають толем?
14. Виведіть формулу, за якою визначають висоту піднімання чи опускання рідини у капілярі.
15. Наведіть приклади врахування і використання капілярних систем у повсякденному житті.