 |
|
Синтез на основе металлоорганических реагентов
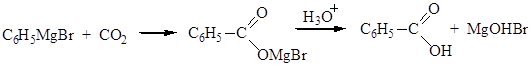
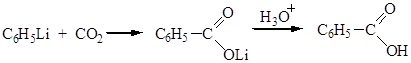
Физические свойства
Монокарбоновые кислоты ароматического ряда – бесцветные кристаллические вещества с температурой плавления выше 100°С. Кислоты с заместителями в п-положении плавятся при гораздо более высоких температурах, чем их изомеры. Температуры кипения и плавления ароматических кислот выше, чем у кислот жирного ряда с тем же числом углеродных атомов. Монокарбоновые кислоты плохо растворяются в холодной воде и значительно лучше – в горячей. Низшие ароматические кислоты летучи с парами воды.
Химические свойства
В водных растворах ароматические монокарбоновые кислоты обнаруживают большую степень диссоциации, чем алифатические кислоты (Ка бензойной кислоты 6,3∙10-5, Ка уксусной кислоты 1,8∙10-5). Большая степень диссоциации бензойной кислоты обусловлена отрицательным индуктивным эффектом бензольного кольца, приводящим к некоторой стабилизации карбоксилат – аниона:

При сравнении силы ряда замещенных бензойных кислот с силой бензойной кислоты видно, что константа диссоциации сильно зависит от природы заместителя и его положения в ядре (табл. 23.1).
Таблица 23.1
Константы диссоциации замещенных бензойных кислот, 105
| Положение R | Заместитель | |||||
| Н | СН3 | ОСН3 | F | Cl | NO2 | |
| орто | 6.27 | 12.3 | 8.06 | 54.10 | 11.40 | 6.71 |
| мета | 6.27 | 5.35 | 8.17 | 13.60 | 14.80 | 32.10 |
| пара | 6.27 | 4.24 | 3.38 | 7.22 | 10.50 | 37.00 |
Гаммет и другие исследователи обнаружили количественную закономерность – простую линейную зависимость между логарифмом константы скорости реакции или равновесия и логарифмом константы диссоциации соответствующих замещенных бензойных кислот. Позднее в 1937 году Гаммет выразил эту зависимость в виде уравнения:
lg k = lg k0 + ρ lg (K/K0),
где k и k0 – константы скорости реакции или равновесия, К и К0 – константы диссоциации соответствующих мета– и пара-замещенных и незамещенной бензойных кислот в воде при 25°С. Если принять
lg (K/K0) = σ,
то зависимость приобретает следующий вид:
lg k = lg k0 + ρσ,
где σ получила название константы заместителя, ρ – постоянная величина, характеризующая реакционную серию и зависящая от типа реакции, природы реакционного центра и условий реакции (растворителя, температуры).
Таблица 23.2
Некоторые константы заместителей
| Заместитель | s | Заместитель | s | ||
| мета | пара | мета | пара | ||
| Оˉ | –0.708 | –1.000 | NH2 | –0.661 | –0.660 |
| ОН | +0.121 | –0.370 | N(CH3)2 | +0.880 | +0.820 |
| ОСН3 | +0.115 | –0.268 | NO2 | +0.710 | +0.778 |
| СН3 | –0.069 | –0.170 | F | +0.337 | +0.062 |
| Н | 0.000 | 0.000 | Cl | +0.373 | +0.227 |
| С6Н5 | +0.060 | –0.010 | COOH | +0.355 | +0.406 |
В таблице 23.2 приведены величины константы заместителей σ. Константы позволяют дать количественную оценку полярного характера соответствующих заместителей. Чем большими электроноакцепторными свойствами обладает заместитель, тем более положительно значение s (по отношению к Н). И наоборот, чем сильнее заместитель подает электроны, тем более отрицательно для него значение s.
Согласно уравнению Гамета, относительная реакционная способность (в логарифмической форме) замещенных производных бензола пропорциональна константе заместителя. Для каждой данной реакции график зависимости lg (k/k0) или lg (К/К0) от s линейный с углом наклона, равным ρ, которую называют константой реакции и которая служит мерой чувствительности реакции к электронным эффектам заместителей (в м– и п-положениях). Высокое значение ρ означает большую чувствительность реакции к влиянию заместителей.
Ароматические кислоты вступают во все те реакции, которые свойственны и кислотам жирного ряда. По карбоксильной группе образуются различные производные кислот: действием щелочей и карбонатов на кислоты получаются соли, эфиры – нагреванием смеси кислоты и спирта в присутствии минеральной кислоты.
Если заместителей в орто-положении нет, то этерификация карбоксильной группы происходит так же легко, как и в случае алифатических кислот. Если одно из орто-положений замещено, то скорость этерификации сильно уменьшается, а если заняты оба орто-положения, то этерификация не идет.
Эфиры орто-замещенных бензойных кислот могут быть получены реакцией серебряных солей с галогеналканами. Эти эфиры с трудом подвергаются гидролизу. Такое явление носит название пространственных (стерических) затруднений. Группы, большие по объему, чем водород, в такой степени заполняют пространство вокруг углеродного атома карбоксильной группы, что затрудняется переход в промежуточное состояние при образовании или омылении эфира.
Хлорангидриды получаются действием на кислоты хлористого тионила или пятихлористого фосфора:
С6Н5СООН + SOCl2 ® С6Н5СОCl + SO2 + HCl
Ангидриды получают перегонкой смеси кислоты с уксусным ангидридом или действием хлорангидридов на соли:
С6Н5СОCl + С6Н5СООNa ® (С6Н5СО)2О + 2 NaCl
При сплавлении соли ароматической карбоновой кислоты со щелочью карбоксильная группа замещается на водород:
С6Н5СОО¯ Na+ + NaOH ® C6H6 + Na2CO3
Отдельные представители
Бензойная кислота. Основными способами получения бензойной кислоты являются окисление толуола и декарбоксилирование фталевой кислоты. Применяется в качестве консерванта в пищевой промышленности благодаря сильному антисептическому действию, а также в производстве красителей и душистых веществ. Очень важным производным бензойной кислоты является ее хлорангидрид – хлористый бензоил. Это жидкость с характерным запахом и сильным лакриматорным действием.
п-трет-бутилбензойная кислота получается в промышленных масштабах окислением п-трет-бутилтолуола в присутствии растворимой соли кобальта в качестве катализатора. Применяется в производстве полиэфирных смол.
ДИКАРБОНОВЫЕ АРОМАТИЧЕСКИЕ КИСЛОТЫ
Известно три бензолдикарбоновых кислоты: фталевая
(о-изомер), изофталевая (м-изомер) и терефталевая (п – изомер). Терефталевая кислота является кристаллическим веществом (Твозг. 300°С), по сравнению с изомерными кислотами наименее растворима в воде и органических жидкостях. Терефталевая кислота и ее диметиловый эфир играют важную роль в производстве синтетического волокна лавсан (терилен) – продукта их поликонденсации с этиленгликолем. Терефталевую кислоту получают окислением п-ксилола.
Изофталевая кислота применяется для производства полиэфиров. Ее получают аналогично терефталевой кислоте – жидкофазным окислением м-ксилола.
АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Лекция 24. НИТРОСОЕДИНЕНИЯ
АЛИФАТИЧЕСКОГО РЯДА
Алифатические нитросоединения. Химические свойства. Гомологический ряд. Изомерия, номенклатура. Способы получения: нитрование алканов, из галогеналканов (реакция Мейера). Получение нитросоединений окислением аминогруппы. Строение нитросоединений. Таутомерия нитросоединений. Реакции по a-углеродному атому: реакции со щелочами, карбонильными соединениями.
Строение солей. Реакции по нитрогруппе. Восстановление, действие минеральных кислот. Нитрометан: получение, применение в технике. Полинитросоединения.
Нитроалканы имеют общую формулу CnH2n+1NO2 или R-NO2. Им изомерны алкилнитриты (эфиры азотной кислоты) с общей формулой R-ONO.
Изомерия нитроалканов связана с изомерией углеродного скелета. Различают первичные RCH2NO2, вторичные R2CHNO2 и третичные R3CNO2 нитроалканы, например:

Номенклатура
Заоснову названия нитроалканов берут название углеводорода с приставкой нитро– (нитрометан, нитроэтан и т.д.). По систематической номенклатуре положение нитрогруппы обозначается цифрой:
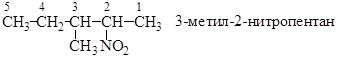
Способы получения нитроалканов