 |
|
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Ø Первое начало термодинамики(закон сохранения энергии) – количество теплоты Q, сообщенное телу, идет на увеличение внутренней энергии ΔU и на совершение телом работы А:
 .
.
Ø Изменение внутренней энергии U идеального газа (энергии теплового хаотического движения молекул):
 .
.
Ø Внутренняя энергия произвольной массы газа:
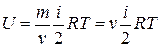 .
.
Ø Приращение работы газа:
 .
.
Ø Полная работа:
 .
.
Ø Удельная теплоемкость – количество теплоты, которое получает или отдает 1 кг вещества при изменении его температуры на 1 К:
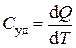 .
.
Ø Молярная теплоемкость – физическая величина, равная отношению теплоемкости вещества к количеству этого вещества:
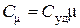 .
.
Ø Теплоемкость при постоянном объеме:
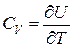 .
.
Ø Теплоемкость при постоянном давлении:
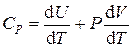 .
.
Ø Уравнение Майера:
CP=CV+R.
Ø Теплоемкость одноатомных газов при постоянном объеме и постоянном давлении:
 и
и  .
.
Ø Показатель адиабаты (коэффициент Пуассона):
 .
.
Ø Молярные теплоемкости многоатомных газов при постоянном объеме и постоянном давлении:
 и
и  ,
,
где i – число степеней свободы молекулы.
Ø Показатель адиабатыдля многоатомных газов:
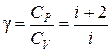 .
.
Ø Внутренняя энергия идеального газа:
 .
.
Ø Средняя кинетическая энергия поступательного движения, приходящаяся на одну степень свободы молекулы:
 .
.
Ø Закон Больцмана о равномерном распределении энергии по степеням свободы:
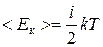 .
.
Ø Изохорический процесс – процесс протекающий при постоянном объеме.
· Количество теплоты, сообщенное в изохорическом процессе:
 или
или 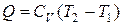 ,
,
где Т1, Т2 – соответственно начальная и конечная температура.
· Изменение внутренней энергии в изохорическом процессе:
 или U = Q.
или U = Q.
· Теплоемкость в изохорическом процессе:
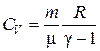 или
или 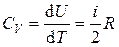 .
.
Ø Изобарический процесс – процесс протекающий при постоянном давлении.
· Работа в изобарическом процессе:
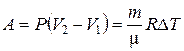 ,
,
где V1и V2– соответственно начальный и конечный объемы газа.
· Количество теплоты, сообщенное в изобарическом процессе:
δQ = СP dT или 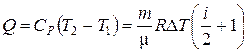 .
.
· Изменение внутренней энергии в изобарическом процессе:
dЕп = СV dT или  .
.
· Теплоемкость в изобарическом процессе:
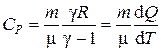 .
.
Ø Изотермический процесс – процесс, протекающий при постоянной температуре.
· Работа газа в изотермическом процессе:
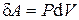 или
или 
Ø Характеристики изопроцессов в газах:
| Название процесса | ||||
| Изохорический | Изобарический | Изотермический | Адиабатический | |
| Условие протекания процесса | V = const | P = const | T = const | δQ = 0
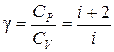
|
| Связь между параметрами состояния | 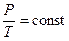
| 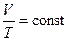
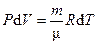
| 
| 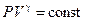
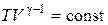

|
| Первое начало | 
| 
| 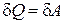
| 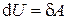
|
| Работа в процессе | 

| 


| 
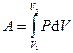
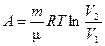

| δA = PdV = - dU
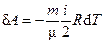 А = −∆U = – CV(T2 - T1)
А = −∆U = – CV(T2 - T1)
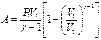 
|
| Количество теплоты, сообщённое в процессе | 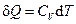 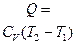
| δQ = СP dT
Q = СP (T2 - T1)
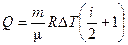
| δQ = δA Q = A | δQ = 0 Q = 0 |
| Изменение внутренней энергии | dU = δQ

| dU = СV dT
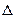 U = СV (T2 - T1) U = СV (T2 - T1)
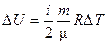
| dU = 0 U = 0 | dU = -δA = = СV dT
U = A = =СV (T2 - T1)
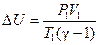
|
| Теплоёмкость | 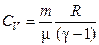 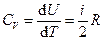
|  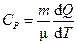
| CТ =  ¥ ¥
| Сад = 0 |
Ø Политропный процесс –такой процесс, при котором изменяются все основные процессы, кроме теплоемкости.
· Уравнение политропы:
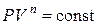 или
или  ,
,
где п – показатель политропы.
Ø Изменение внутренней энергии идеального газа:
