 |
|
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ
Ø Молярная масса вещества:
 или
или  ; для смеси газов:
; для смеси газов:  .
.
Ø Атомная масса: отношение массы этого элемента 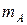 к 1/12 массы изотопа углерода С12 :
к 1/12 массы изотопа углерода С12 :
 .
.
Ø Атомная единица массы – единица массы, равная 1/12 массы изотопа углерода 12С – тС:
 .
.
Ø Число Авагадро – число частиц в киломоле любого вещества:

Ø Число Лошмидта – число молекул идеального газа, содержащихся в 1 м3 при нормальных условиях (  ):
):
 .
.
Ø Под идеальным газом понимается:
• радиус взаимодействия молекул меньше среднего расстояния между ними (молекулы взаимодействуют только при столкновении);
• столкновение молекул между собой и со стенками сосуда – абсолютно упругие (выполняются законы сохранения энергии и импульса);
• объем всех молекул газа много меньше объема, занятого газом.
Ø Универсальная газовая постоянная – это величина, численно равная работе расширения одного моля идеального одноатомного газа в изобарном процессе при увеличении температуры на 1 К:
 ,
,
где  – постоянная Больцмана.
– постоянная Больцмана.
Ø Концентрация частиц:
 .
.
Ø  Давление на поверхность:
Давление на поверхность:
 ,
,
где  сила, действующая на поверхность
сила, действующая на поверхность  .
.
Ø Давление газа на стенку сосуда – это следствие столкновения газовых молекул со стенками сосуда:
 ,
,
где  среднеквадратичная скорость молекул
среднеквадратичная скорость молекул  ; т0 – масса одной молекулы.
; т0 – масса одной молекулы.
Ø Закон Паскаля: если к некоторой части поверхности, ограничивающей газ или жидкость, приложено давление  , то оно одинаково передается любой части этой поверхности.
, то оно одинаково передается любой части этой поверхности.
Ø Основное уравнение МКТ:
 ,
,
где  средняя энергия одной молекулы; п – концентрация молекул.
средняя энергия одной молекулы; п – концентрация молекул.
Ø Абсолютная температура – это мера кинетической энергии теплового движения частиц идеального газа:
 .
.
Ø Сравнение температурных шкал:

Ø Объем газа в трубке газового термометра:
 .
.
Ø Законы идеальных газов:
1. Изохорический процесс – процесс, протекающий при постоянном объёме V.
Закон Шарля: при постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.


Если температура газа выражена в градусах Цельсия, то уравнение изохорического процесса записывается в виде

где Р0 – давление при 0°С, α =1/273 град-1 – температурный коэффициент.
 2. Изобарический процесс – процесс, протекающий при постоянном давлении.
2. Изобарический процесс – процесс, протекающий при постоянном давлении.
Закон Гей-Люссака: при постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным:
V/T = const.
3. Изотермический процесс – процесс, протекающий при постоянной температуре Т.
Закон Бойля – Мариотта: при постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным:  .
.
4. Адиабатический процесс(изоэнтропийный (ΔS = 0, S = const)):
Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой.
Уравнение адиабаты:  ,где γ – показатель адиабаты.
,где γ – показатель адиабаты.
5. Политропический процесс – процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов.
6. Закон Авогадро: моли любых газов, при одинаковых температуре и давлении, занимают одинаковые объемы. При нормальных условиях объем моля равен
Vμ = 22,41·10–3 м3/моль.
Моль – это стандартизированное количество любого вещества, равное его молекулярной массе.
7. Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в нее газов:
 .
.
8. Объеденный газовый закон (закон Клапейрона):
 или
или  .
.
Ø Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона):
 ; для смеси газов:
; для смеси газов: 