 |
|
Ізомерія – це явище існування сполук з однаковим хімічним складом, але з різною будовою і властивостями.
Геометрична ізомерія в координаційних сполуках спостерігається тоді, коли ліганди у внутрішній сфері розміщуються по – різному відносно один одного.
Геометричні ізомери відрізняються за:
Фізичними
Хімічними властивостями
[Co(NH3)4Cl2]Cl
Оптичні ізомери відносяться один до одного як предмет і його дзеркальне відображення. Два оптичні ізомери обертають площину поляризації світла на однаковий кут: один-вправо, а другий-вліво.
За фізичними і хімічними властивостями оптичні ізомери практично не відрізняються один від одного. Причиною сольватної ізомерії є неоднаковий розподіл молекул розчинника між внутрішньою і зовнішньою сферами координаційної сполуки. Для кристалогідратів таку ізомерію називають гідратною.
Кристалогідрат хлориду Cr(III), CrCl3 6H2O, [Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2 H2O, [Cr(H2O)4Cl2]Cl 2H2O, [Cr(H2O)3Cl3] 3H2O.
Іонізаційна ізомерія зумовлена різним розподілом іонів між внутрішньою і зовнішньою сферами, наприклад: [Co(NH3)5Br]SO4, [Co(NH3)5SO4]Br, [Pt(NH3)4Cl2]Br2 i [Pt(NH3)4Br2]Cl2.
Координаційна ізомерія зв’язана з переходом лігандів від одного комплексоутворювача до другого: [Co(NH3)6][Cr(CN)6] i [Cr(NH3)6][Co(CN)6].
Ізомерія зв’язку може виявлятись тоді, коли ліганди містять два різних атоми, здатних координуватись з центральним атомом. Наприклад, у солях з [Co(NH3)5ONO]X2 i [Co(NH3)5NO2]X2 група ONO зв’язана з Со(ІІІ) через кисень, а група NO2 – через азот.
Комплексні сполуки поділяють на:
| Електроліти | Неелектроліти |
| При розчиненні у воді (чи іншому розчиннику) взаємодіють з нею, дисоціюючи на іони. | Електролітичній дисоціації не піддаються. |
Комплексні сполуки – електроліти, по специфіці дисоціації поділяють на кислоти, основи і солі. Наприклад, розчинення у воді кристалічного комплексного гідрату H2PtCl6 6H2O описують схемою:

Ця реакція відбувається з утворенням іонів водню, відповідно, розчин цього гідрату являє собою комплексну кислоту. Розчинення у воді кристалічного(NH4)2SiF6 описується схемою:
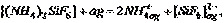
згідно якої (NH4)2SiF6 – комплексна сіль.
Комплексна сполука Ag(NH3)2OH взаємодіє з H2O за схемою:

тобто розчин збагачується іонами гідроксилу і набуває основних властивостей, відповідно Ag(NH3)2OH – основа.