 |
|
Гідроксиди та їх похідні
Із гідроксидів типу Е(ОН)2 відома тільки малорозчинна основа Сr(ОН)2, яку одержують дією на розчини солей Cr2+ лугами у відсутності кисню. Cr(OH)2 та солі Cr2+ - сильні відновники і вже на повітрі окиснюються до сполук Cr3+:
4CrCl2 + O2 + 4HCl → 4CrCl3 + 2H2O.
Гідроксид Cr(OH)3 осаджується з розчинів солей Cr3+ дією лугів у
вигляді зелено-сірого драглистого осаду:
CrCl3 + 3NaOH → Cr(OH)3 + 3NaCl.
Cr(OH)3 проявляє амфотерні властивості і при взаємодії з лугами утворює гідроксокомплекси складу Me+n[Cr(OH)n+3], n = 1, 2, 3 і зростає зі збільшенням концентрації лугу:
Cr(OH)3 + NaOH → Na[Cr(OH)4];
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6].
При прожарюванні ці солі втрачають воду і утворюють безводні хроміти:
Na[Cr(OH)4] → NaCrO2 + 2H2O.
NaCrO2 є сіллю не існуючої у вільному стані метахромітної кислоти НСrО2.
Гідроксохромати (ІІІ) можна одержати також, діючи надлишком лугу на солі Сr 3+:
CrCl3 + 6NaOH → Na3[Cr(OH)6] + 3NaCl.
Розчиняючись у кислотах, Cr(OH)3 утворює солі хрому (ІІІ):
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3+ 6H2O;
Cr(OH)3 + 3HCl → CrCl3 + 3H2O.
У водних розчинах Cr3+ існує тільки у вигляді [Cr(H2O)6]3+, який частково гідролізує:
[Cr(H2O)6]3+ + H2O  [Cr(H2O)5OH]2+ + H3O+.
[Cr(H2O)5OH]2+ + H3O+.
Сполуки Cr(III) різноманітні за забарвленням: жовті, оранжеві, червоні, коричневі, зелені, сині, фіолетові та чорні.
Солі хрому (ІІІ) схильні до гідролізу. На першій стадії гідролізу:
[Cr(H2O)6]3+ + H2O  [Cr(H2O)5OH]2+ + H3O+.
[Cr(H2O)5OH]2+ + H3O+.
Солі слабких кислот гідролізують повністю, тому добути з водного розчину сульфід, карбонат хрому (ІІІ) не можна:
Cr2(SO4)3 + 3Na2CO3 + 3H2O → 2Cr(OH)3 + 3Na2SO4 + 3CO2.
За здатністю до гідролізу та утворенню подвійних сульфатів типу галунів (КСr(SO4)2·12Н2О) сполуки хрому (ІІІ) подібні відповідним сполукам алюмінію та заліза (ІІІ):
Cr2(SO4)3 + K2SO4 + 24H2O → 2KCr(SO4)2 · 12H2O.
У кислому середовищі сполуки хрому (ІІІ) можуть відновлюватись до сполук хрому (ІІ); у лужному середовищі – окиснюватись до сполук
хрому (VІ):
2CrCl3 + H2 → 2CrCl2 + 2HCl;
Cr2(SO4)3 + KClO3 + 10KOH → 2K2CrO4 + 3K2SO4 + KCl + 5H2O;
K[Cr(OH)4] + 3K3[Fe(CN)6] + 4KOH → K2CrO4 + 3K4[Fe(CN)6] + 4H2O;
2K[Cr(OH)4] + 3H2O2 + 2KOH → 2K2CrO4 + 8H2O;
2K[Cr(OH)4] + 3PbO2 + 8KOH → 2K2CrO4 + 3K2[Pb(OH)4] + 2H2O.
Існують численні моно- та багатоядерні комплексні сполуки Сr+3 з координаційним числом 6. За природою лігандів це аміни, аквааміни, ацидосолі тощо.
Наприклад: [Cr(NH3)6]Cl3, [Cr(H2O)6]Cl3, [Cr(H2O)2(NH3)3Cl]Cl2, K3[Cr(CN)6], K3[CrCl6], K3[Cr(C2O4)3], H4[Cr2(SO4)5], [Cr3(CH3COO)6(OH)2]CH3COO.
Відомий гексакарбоніл хрому [Cr(CO)6] - безбарвна кристалічна речовина зі ступенем окиснення Сr ноль, що повільно розкладається при освітленні та з вибухом при нагріванні на хром та СО.
При нагріванні Cr(OH)3 перетворюється у Cr2O3:
2Cr(OH)3 → Cr2O3 + 3H2O.
Існує малорозчинний у воді та кислотах Мо(ОН)3, він є сильним відновником – розкладає Н2О з виділенням Н2.
Найбільш відомі гідроксидні похідні Сr+6, Мо+6 та W+6. Це перш за все кислоти типу Н2ЕО4, Н2Е2О7 та солі, що їм відповідають.
Хромова Н2СrО4 та дихромова Н2Сr2О7 кислоти є електролітами середньої сили, існують тільки у водних розчинах. Але солі, що відповідають їм, – жовті хромати (аніон СrО42-) та оранжеві дихромати (аніон Сr2О72-) є стійкими, їх можна виділити із розчинів.
У кислому середовищі хромат-іон переходить у дихромат-іон:
2CrO42- + 2H+  H2O + Cr2O72-,
H2O + Cr2O72-,
і навпаки, під дією лугів дихромат-іон перетворюється у хромат:
Cr2O72- + 2OH-  H2O + 2CrO42-.
H2O + 2CrO42-.
Це так звана хромат – дихроматна рівновага.
Хромати, особливо дихромати, – сильні окисники. Продуктами відновлення є похідні хрому (ІІІ). У нейтральному середовищі утворюється, як правило, Сr(ОН)3:
K2Cr2O7 + 3(NH4)2S + H2O → 2Cr(OH)3 + 3S + 6NH3 + 2KOH.
у лужному – гідроксохромати (ІІІ):
2Na2CrO4 + 3(NH4)2S + 2NaOH + 2H2O → 2Na3[Cr(OH)6] + 3S + 6NH3.
Але найбільша окиснювальна здатність проявляється у кислому середовищі:
K2Cr2O7 + 14HCl → 2CrCl3 + 3Cl2 + 2KCl + 7H2O;
K2Cr2O7 + 3C2H5OH + 4H2SO4 →
| →Cr2(SO4)3 + K2SO4 + 3 | 
| + 7H2O |
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O.
Молібденові та вольфрамові кислоти утворюють полікислоти, які малорозчинні у воді. Це, наприклад,: H2MoO4, H2Mo2O7, H2[Mo4O13], H2WO4, H2W2O7. Солі цих кислот - молібдати та вольфрамати – стійкі сполуки, їх одержують, як правило, взаємодією ЕО3 з лугами чи оксидами металів:
EO3 + 2NaOH → Na2EO4 + H2O;
4MoO3 + 2NaOH → Na2[Mo4O13] + H2O;
EO3 + CaO → CaEO4;
2WO3 + Na2O → Na2W2O7.
Для Мо+6 та W+6 відомі багаточисельні похідні полімерних оксоаніонів типу Еn О2-3n+1 (n = 2, 3, 4) та інших більш складних ізополімолібдатів та ізополівольфраматів. Склад ізополісполук залежить від умов їх одержання в результаті взаємодії М+2МоО4 та М+2WО4 з кислотами – від температури, концентрації розчинів, рН, терміну взаємодії. В лужних розчинах стійкі прості молібдати та вольфрамати ЕО42-, при рН=6,6 стійкі гексамолібдати та гексавольфрамати [Е6О21]6-; при рН = 1-2 стабільні додекамолібдати та додекавольфрамати [Н2Е12О40] 6-.
Для Мо та W є характерним утворення гетерополікислот, тобто полікислот, які в аніоні, крім кисню, Мо чи W, містять ще і інший елемент, як правило, – Р, Sі, В тощо. Гетерополісполуки утворюються при підкисленні суміші кількох простих солей, наприклад, Nа2МоО4 та Nа2SіО3 чи при змішуванні відповідних кислот:
12Na2EO4 + Na2SiO3 + 22HNO3 → Na4[SiE12O4] + 22NaNO3 + 11H2O;
12Na2EO4 + H3PO4 + 21HNO3 → Na3[PE12O40] + 21NaNO3 + 12H2O.
Назви гетерополіаніонів включають число атомів Мо чи W та назву гетероелемента, наприклад, [SiMo12O40]4- -12-молібдосилікат чи [PW12O40]3- -фосфо-12-вольфрамат. Найбільш багаточисельними та стійкими є 6 та 12-гетерополісполуки Мо та 12-гетерополісполуки W. 6-гетерополісполуки Мо мають кільцеву структуру. Для встановлення структури ізополісполук застосовують різні фізико - хімічні методи.
Для Cr+6, Мо+6, W+6 характерне утворення пероксосполук. Відомий пероксид хрому (VІ) – СrО5 або СrО(О2)2 у вигляді нестійкого розчину синього кольору. СrО5 реагує з лугами та кислотами, проявляючи при цьому окисні властивості:
CrO5 + 2KOH → K2CrO4 + H2O + O2;
4CrO5 + 6H2SO4 → 2Cr2(SO4)3 + 7O2 + 6H2O.
При дії на СrО5 пероксиду водню та спиртового розчину КОН чи NН3 утворюються пероксохромати К2Сr2О12 · 2Н2О чи (NН4)2Сr2О12·2Н2О, тверді кристалічні речовини, що розкладаються з утворенням кисню:
2K2Cr2O12  2K2Cr2O7 + 5O2.
2K2Cr2O7 + 5O2.
Існують пероксомолібденові кислоти - Н2МоО5, Н2[ Мо(О2)4] та їх солі.
Лабораторна робота
Дослід 1. Одержання та властивості гідроксиду хрому (ІІІ)
У дві пробірки внести по 5 краплин розчину солі хрому (ІІІ) і додати розбавлений розчин NH3 до утворення осаду гідроксиду хрому (ІІІ). В першу пробірку додати розчин сірчаної кислоти, а в другу - розчин
гідроксиду натрію до розчинення осаду. У другу пробірку краплинами додати розчин соляної кислоти доки нез’явиться помутніння або осад. Написати рівняння реакцій, що відбуваються.
Дослід 2. Окисні властивості дихромату калію
У пробірку внести 5 краплин розчину дихромату калію, 5 краплин розчину сірчаної кислоти та 5 краплин розчину йодиду калію. Додати
2–3 краплини органічного розчинника, перемішати. Описати спостереження. Написати рівняння реакції.
Дослід З. Вивчення хромат – дихроматної рівноваги.
До 5 – 6 краплин розчину хромату калію додати 3 – 4 краплини сірчаної кислоти. Відмітити зміну кольору розчину. До одержаного розчину додати краплинами розчин гідроксиду натрію до зміни кольору. Скласти рівняння реакцій переходу хромат-іонів у дихромат і навпаки.
Вправи
1. Під час сплавлення 3,03кг оксиду хрому(ІІІ) з окисником у присутності гідроксиду натрію отримано 6,37кг хромату натрію. Визначити вихід продукту.
2. Визначити процентний вміст дихромату натрію в технічному продукті, якщо для відновлення 1кг останнього потрібно 3,38кг КІ.
3. Скільки мілілітрів розчину дихромату калію з с( 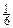 K2Cr2O7) = 0,5моль/л потрібно для повного окиснення 22г йодиду калію у кислому середовищі? Навести рівняння реакції, яка відбувається.
K2Cr2O7) = 0,5моль/л потрібно для повного окиснення 22г йодиду калію у кислому середовищі? Навести рівняння реакції, яка відбувається.
4. Що являє собою “хромова суміш”? Як її готують та де використовують? Чим зумовлені властивості цієї суміші?
5. Сполуки хрому вилучають з мінералу Fe(CrO2)2, сплавляючи його з содою в присутності кисню. Хромат, що отримано, переводять у дихромат, а останній відновляють вуглецем до оксиду хрому(ІІІ). Скласти рівняння всіх реакцій, що відбуваються у цьому процесі.
6. Скільки мілілітрів розчину гідроксиду калію з с(КОН) 8моль/л потрібно для розчинення 78г гідроксиду хрому(ІІІ), якщо при цьому утворюється комплексна сполука з координаційним числом Cr (ІІІ)?
7. На відновлення 300мл розчину дихромату калію, с( 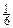 K2Cr2O7) 0,2моль/л у кислому середовищі витрачено 500мг розчину хлориду олова(ІІ). Визначити масову та молярну концентрації розчину хлориду олова(ІІ). Навести рівняння реакції, яка відбувається.
K2Cr2O7) 0,2моль/л у кислому середовищі витрачено 500мг розчину хлориду олова(ІІ). Визначити масову та молярну концентрації розчину хлориду олова(ІІ). Навести рівняння реакції, яка відбувається.
8. Які властивості проявляє метахроміт калію під час його взаємодії з оксидом свинцю(ІV) у лужному середовищі та з бромною водою у лужному середовищі? Написати рівняння реакцій, вказати окисник та відновник.
9. Як перевести хромати лужних металів у дихромати та навпаки? Як з дихромату калію можна отримати хромовий галун, а з хромового галуну – дихромат?
10. Скласти рівняння реакції, яка відбувається в процесі прожарювання дихромату амонію. Навести електронні рівняння та вказати окисник та відновник. Які властивості має тверда речовина, що утворюється у цій реакції?
11. Якщо до розчину хлориду хрому(ІІІ) додати луг, осад, що спочатку випав, при надлишку лугу розчиняється. Якщо додати бром до цього смарагдово-зеленого розчину, колір змінюється на жовтий. Пояснити ці явища та скласти рівняння відповідних реакцій.