 |
|
Промисловість реактивів і особливо чистих речовин. 13 страница
Знаючи практичний вихід речовини при електролізі і теоретично розраховану кількість за законами Фарадея, визначають вихід за струмом:
 ,
,
де: Gф – фактично добута кількість речовини, г; Gm – теоретично розрахована кількість речовини, г.
Кількість речовини Gm обчислюється за законами Фарадея відповідно до кількості витраченого на електроліз електричного струму:
 ,
,  ,
,
де: k – електрохімічний еквівалент речовини; I – сила струму, А; 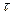 – час проходження струму, год; E – хімічний еквівалент речовини; F – число Фарадея.
– час проходження струму, год; E – хімічний еквівалент речовини; F – число Фарадея.
Тоді вихід за струмом (в %) становитиме:
 .
.
Найважливішим показником економічності електрохімічних процесів є витрата енергії при електролізі на одиницю добутої продукції. Фактично витрачена енергія  визначається у кіловат-годинах на 1 кг або 1 т і дорівнює добутку кількості витраченої енергії в ампер-годинах на напругу на електролізері у вольтах:
визначається у кіловат-годинах на 1 кг або 1 т і дорівнює добутку кількості витраченої енергії в ампер-годинах на напругу на електролізері у вольтах:
 , (13.1)
, (13.1)
де: Uф – середня робоча напруга на ванні, В.
Відношення кількості електроенергії, теоретично необхідної для проведення цього процесу, до фактично витраченої кількості у цьому процесі називається коефіцієнтом використання енергії, у відсотках він дорівнює:
 . (13.2)
. (13.2)
Теоретична витрата електроенергії (у кВт·год) на одиницю виробленої продукції визначається за рівнянням
 , (13.3)
, (13.3)
де Um –теоретична напруга розкладання, В.
Таким чином, після підставлення у рівняння (13.2)  з рівняння (13.3) і Wф з рівняння (13.1) дістанемо, %:
з рівняння (13.3) і Wф з рівняння (13.1) дістанемо, %:
 . (13.4)
. (13.4)
З рівняння (13.4) випливає, що коефіцієнт використання енергії тим більший, чим вищий вихід за струмом і чим менша різниця напруг практичної (на ванні) і теоретично розрахованої. Коефіцієнт використання енергії невеликий при електролізі розчинів (не більше 50–60 %) і ще менший при електролізі розплавів.
13.2. Електроліз водних розчинів.
Виробництво їдкого натру і хлору
Електроліз водних розчинів можна здійснювати як без виділення на катоді металів, так і з виділенням. Серед електрохімічних процесів, які відбуваються без виділення металів, найбільш поширений електроліз водних розчинів NaCl, який здійснюється для добування NaOH (каустичної соди), Cl2 і Н2. При електролізі водних розчинів хлоридів лужних металів утворюються їдкі луги, Сl2 і Н2, а при електролізі розплавів хлоридів – легкі метали і хлор. Електроліз водних розчинів хлоридів лужних металів здійснюють у промислових масштабах ще з 1890 р.
Теоретичні основи електролізу розчину NaCl з твердим (залізним) катодом.Електроліз розчину NaCl у ваннах з залізним (стальним) катодом і графітовим анодом дає змогу одержувати NaOH, Сl2 і Н2 в одному апараті (електролізері). У водному розчині NaCl дисоціює, і у рівноважному стані відбуваються такі реакції:
NaCl  Na+ + Cl–
Na+ + Cl–
При проходженні постійного електричного струму через цей розчин хлорид-йони і гідроксид-йони можуть розряджатися:
2Cl– – 2e 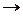 Cl2 (13.5)
Cl2 (13.5)
4OH– – 4e 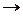 O2 + 2H2O, (13.6)
O2 + 2H2O, (13.6)
або
2H2O – 4e 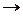 O2 + 4H+. (13.7)
O2 + 4H+. (13.7)
Нормальний електродний потенціал розряджання йонів ОН– дорівнює +0,41 В, а нормальний електродний потенціал розряджання хлорид-йонів – +1,36 В. У нейтральному насиченому розчині NaCl концентрація йонів ОН– близько 1·10-7 моль-екв/л. При 25 °С рівноважний потенціал розряджання йонів ОН– буде:
 .
.
Рівноважний потенціал розряджання хлорид-йонів при концентрації NaCl у розчині 4,6 моль-екв/л дорівнює:
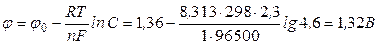 .
.
Отже, на аноді з малою перенапругою має насамперед розряджатись О2. Але на графітових анодах О2 виділяється з великою перенапругою, більшою ніж для СІ2 і тому відбувається розряджання хлорид-йонів, внаслідок чого за реакцією (13.5) утворюється газоподібний СІ2. Велика концентрація NaCl у розчині сприяє зменшенню величини рівноважного потенціалу, тобто виділенню СІ2.
Нормальний потенціал розряджання йонів Na+ на твердому катоді у нейтральному розчині дорівнює –2,71 В. Рівноважний потенціал розряджання Н2 у тих же умовах становить –0,415 В. При такій великій різниці між потенціалами розряджання на твердому катоді навіть при значній перенапрузі розряджаються тільки йони Н+, що утворились внаслідок дисоціації води:
2Н++2е 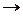 2Н
2Н 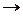 Н2.
Н2.
Йони Na+ і ОН-, що залишились у розчині, утворюють їдкий натр. Таким чином, при електролізі водних розчинів NaCl добувають газоподібні Cl2 і Н2 та NaOH у розчині. При електролізі розчину NaCl на 1 т Cl2 утворюється 1,139 т NaOH і до 300 м3 Н2.
Недоліком електролізу розчину NaCl є те, що під час електролізу відбувається багато побічних процесів, які призводять до зайвої витрати енергії, не дають змоги добувати чисті продукти, спричинюють труднощі при конструюванні апаратури для проведення електролізу, а також знижують вихід за струмом і коефіцієнт використання енергії.
Для промислового електролізу аноди виготовляють з графіту. Внаслідок великої перенапруги хлору на графіті величини потенціалів розряджання йонів Cl- і ОН‑ стають близькими, тому одночасно з Cl2 на аноді виділяється О2 за рівнянням (6). Хлор частково реагує з водою:
Cl2 + Н2О = НCl + НClО.
Хлорнуватиста і хлоридна кислоти нейтралізуються лугом з утворенням гіпохлориту і натрію хлориду:
НCl + NaOH = NaCl + Н2О;
НОСІ + NaOH = NaOCl + Н2О.
Йони ClO- легко розряджаються на аноді разом з йонами Сl- при наявності йонів ОН-, окиснюючись за реакцією
6ClО– + 6ОН– – 6е– = 2ClО3 + 4Сl– + 3O + 3Н2О.
Кисень, який виділяється на аноді, реагує з вуглецем графітового анода, утворюючи CO і CO2. Хлорнувата і хлоридна кислоти реагують з NaOH, утворюючи гіпохлорит і натрію хлорид.
Щоб запобігти виникненню побічних процесів і змішуванню продуктів електролізу, слід відокремлювати катодний і анодний простори один від одного фільтруючою діафрагмою, застосовуючи фільтрування електроліту через діафрагму у напрямі, протилежному до руху йонів ОН-. Діафрагми найчастіше виготовляють з азбесту. Підвищення температури електролізу і концентрації NaCl в електроліті зменшує розчинність Cl2, а зниження концентрації NaOH у католіті зменшує можливість побічних процесів. Збільшення концентрації NaOH у католіті вище 155 г/л різко зменшує вихід за струмом. Підвищення температури електролізу збільшує вихід за струмом і електропровідність електроліту, що призводить до зниження напруги на ванні і зменшення витрат енергії. Тому електроліз розчинів NaCl здійснюють при 70-80оС.
Напруга при електролізі насиченого водного розчину NaCl визначається як алгебраїчна різниця рівноважних анодного і катодного потенціалів:
Um =1,33-(-0,84) =2,17В,
де: 1,33 – рівноважний потенціал анода у насиченому розчині NaCl, В; –0,84 – рівноважний потенціал твердого катода, В.
Практично напруга на ванні становить 3,35‑3,8 В залежно від умов перебігу процесу електролізу.

| |
| Рис. 13.1. Схема електролітичної ванни з вертикальною фільтрувальною діафрагмою: 1 – діаграма; 2 – катод; 3 – катодний простір; 4 – анод; 5 – анодний простір | Рис. 13.2. Схема електролітичної ванни з ртутним катодом: А – електролізер; Б – розкладач амальгами натрію |
На рис. 13.1, наведено схему електролізера з вертикальною діафрагмою. Ванна має перфорований залізний катод 2 і графітовий анод 4. До катода щільно прилягає фільтруюча азбестова діафрагма 1. Розчин NaCl подається в анодний простір 5, фільтрується крізь діафрагму, досягає катода і попадає у катодний простір 3. Швидкість V (см3 /г) фільтрації електроліту зумовлена просочуваністю діафрагми і залежить від площі перетину діафрагми S (см2), гідростатичного тиску стовпа електроліту h (см) і густини електроліту r(Па ∙ с):
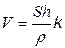 ,
,
де k – коефіцієнт просочуваності, що враховує пористість діафрагми.
У ваннах повного розкладання NaCl не відбувається, а встановлюється постійна концентрація лугу і NaCl, що не розклався. У розчині, що витікає з ванни, міститься 110-120 г/л NaОН і 170-180 г/л NaCl.
Для збільшення продуктивності вертикальних циліндричних ванн в їх конструкцію введено додаткові катоди.
Нині широко використовують потужні прямокутні ванни з вертикально розміщеними електродами і з осадженою азбестовою діафрагмою. Покриття катода складної конструкції осадженою діафрагмою досягається нанесенням за допомогою вакууму на його поверхню тонкого шару азбестового волокна з соляно-лужного розчину, в якому міститься розмочений азбест.
Ванна з осадженою діафрагмою працює при 94‑97°С. При силі струму 10000 А і напрузі 3,75 B вихід за струмом становить 96 %, а коефіцієнт використання енергії досягає 60 %.
Крім твердого залізного катода при електролізі розчинів NaCl застосовують також рідкі ртутні катоди. Електроліз розчинів NaCl у ваннах з ртутним катодом і графітовим анодом дає змогу добувати більш концентровані продукти, ніж у ваннах з діафрагмою.
У ваннах з ртутним катодомхлорид-йони розряджаються на графітовому аноді з подальшим утворенням газоподібного Cl2. На ртутному катоді Н2 виділяється з великою перенапругою: якщо на залізному катоді потенціал виділення Н2 з нейтрального розчину дорівнює 0,415 В, то на ртутному катоді він становить 1,7-1,85 В. Натрій же на ртутному катоді виділяється з великим ефектом деполяризації, зумовленим утворенням амальгами натрію. Завдяки цьому потенціал розряджання натрію на ртутному катоді нижчий, ніж рівноважний, а саме 1,2 В. Отже, на ртутному катоді відбувається такий процес:
Hg + Na+ + е– 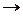 NaHg.
NaHg.
Електролізер з ртутним катодом (рис. 13.2) складається з двох окремих апаратів: власне електролізера А і розкладача Б амальгами натрію водою:
NaHg + Н2О = NaOH + ½ H2+ Hg.
Вивільнену після розкладання амальгами Hg знову подають в електролізер. При електролізі на ртутному катоді можна добути чистий NaOH з концентрацією 600‑700 г/л. Недоліком ванн з ртутним катодом є те, що металічна Hg дуже отруйна, експлуатація їх складніша і витрата електроенергії вища, ніж у діафрагмових ваннах. Але можливість добування у ртутних ваннах концентрованих лугів, вільних від NaCl, є істотною їх перевагою. Електроліз у ваннах з ртутним катодом набув нині великого поширення.
13.3. Переробка електролітичного хлору.
Виробництво хлоридної кислоти
Хлор, добутий в електролітичному цеху, зріджують або відправляють на переробку. Зріджений Сl2 легше зберігати, транспортувати трубопроводами для внутрішніх потреб і перевозити у цистернах і балонах. Зріджують його трьома способами: за допомогою підвищеного тиску (до 1,2 МПа без охолодження); методом "глибокого" охолодження (до –35-45 °С); помірним охолодженням (до –18 °С) і стисненням (до 0,5 МПа). Зріджений Сl2 за допомогою чистого, сухого та охолодженого повітря подається у залізничні цистерни або у стальні балони.
Рідкий Сl2 – це оливна рідина темно-зеленого кольору, яка кипить при атмосферному тиску при –34,6 °С. При охолодженні рідкого Сl2 до –101,5 °С він твердне. Рідкий Cl2 використовується для відбілювання тканин, паперу, целюлози, для дезинфекції питної води; хлорування руд, як розчинник та ін.
Виробництво водню хлориду і хлоридної кислоти.Хлороводень використовується для виробництва хлоридної кислоти і хлорорганічних продуктів.
Хлоридна кислота є розчином НСl у воді. Вона належить до сильних кислот, якою широко користуються у лабораторній практиці і промисловості для добування хлоридів металів, у гальванопластиці, гідрометалургії, при паянні і лудінні металів, при бурінні нафтових свердловин, при гідролізі крохмалю, для очищення парових котлів від накипу, у виробництві анілінових барвників, у побуті та ін.
Відповідно до державних стандартів, хлоридна кислота випускається з концентрацією НСl не менш як 27,5 і 31 %.
Хлороводень –це безбарвний газ, температура плавлення якого – 114,2°С, а температура кипіння – 85 °С. При тиску 0,1 МПа 1 л води при 0 °С розчиняє 525,2 л НСl, що становить у розчині 46,15 мас. % НСl. При 18 °С у 1 л води розчиняється 451,2 л НСl (42,34 мас. %). Хлороводень з водою утворює азеотропну суміш, яка містить при 0,1 МПа 20,24 % НСl і кипить при 110 °С. Хлороводень використовується у великих кількостях для гідрохлорування органічних сполук, у виробництві синтетичних смол, каучуків та ін.
Основним способом виробництва хлоридної кислоти є синтез НСl з електролітичних Сl2 і Н2 і абсорбція синтетичного НСl водою. Реакція між Cl2 і Н2 відбувається з виділенням теплоти без зміни об'єму:
Н2 + Cl2 = 2НCl + 184,2 кДж.
Константа швидкості цієї реакції з підвищенням температури зростає.
Синтез НСl здійснюють при надлишку Н2 на 5-10 %, що дає змогу повніше використовувати Cl2 і виробляти хлоридну кислоту, яка не містить вільного Cl2. Процес синтезу відбувається у печах з повітряним або водяним охолодженням. На виході з печі НСl охолоджується у повітряному холодильнику і надходить на абсорбцію його водою або на концентрування і висушування.
Хлоридна кислота утворюється внаслідок абсорбції НСl водою в апаратах-абсорберах з відведенням теплоти через стінку (ізотермічна абсорбція) або в абсорберах з відведенням теплоти за рахунок випаровування частини води (адіабатична абсорбція), що відбувається при підвищенні температури кислоти під час розчинення НСl. Це призводить до збільшення тиску її парів і інтенсивного випаровування води. Для підвищення концентрації хлоридної кислоти встановлюють додатковий абсорбер, в якому її донасичують хлороводнем.
Хлоридну кислоту зберігають у стальних цистернах ємністю до 50 м3 або баках ємністю до 100 м3, футерованих поверх гумової прокладки кислототривкою плиткою. Перевозять хлоридну кислоту у гумованих цистернах, контейнерах, бочках або скляних бутлях. Харчову хлоридну кислоту перевозять у скляних бутлях ємністю до 30 л, які закривають чистими дерев'яними пробками.
Виробництво хлорного вапна і гіпохлоритів.Хлорне вапно – це білий сухий порошок, який має запах хлору. До його складу входять кальцій гіпохлорити: нейтральний Са(ОCl)2 ∙ 3Н2О та основні 3Са(ОCl)2 ∙ 2Са(ОН)2 ∙ 2Н2О та Са(ОCl)2 ∙ Са(ОН)2, а також кальцій хлориди СаCl2 ∙ Са(ОН)2, СаCl2 і вільне вапно Са(ОН)2.
Вибілювальні і дезинфікуючі властивості хлорного вапна визначають кількістю активного Сl2 який виділяється при обробці зразка хлоридною кислотою:
Са(ОCl)2 + 4HC1 = 2C12 + СаСl2 + 2H2O.
За цим рівнянням кількість виділеного активного Cl2 становить близько 100 % маси гіпохлориту кальцію, але практично міститься 32‑35 % активного Cl2.
Основним споживачем хлорного вапна є целюлозно-паперова промисловість, де його використовують для вибілювання целюлози і паперової маси. Крім того, ним користуються для дезинфекції, для боротьби із збудниками хвороб та ін.
Сировиною для виробництва хлорного вапна є газоподібний Cl2 і гашене вапно. Реакція утворення гіпохлориту відбувається з виділенням великої кількості теплоти:
2Са(ОН)2 + 2Cl2 = Са(ОСl)2 + СаCl2 + 2Н2О + Q.
На кожний кілограм Сl2, що вступає у реакцію, виділяється 1046 кДж теплоти. Реакція відбувається тільки між вологими компонентами.
Процес хлорування вапна відбувається у багатополичкових камерах, подібних до печей для спалювання колчедану, або у похилих барабанних установках, конструкція яких нагадує обертові печі.
Останнім часом виробляється стійкий продукт хлорування вапна – твердий кальцій гіпохлорит Са (ОCl)2, в якому активного хлору значно більше. Його добувають взаємодією Cl2 з вапняним молоком. Кальцію гіпохлорит як малорозчинна речовина випадає в осад, який після фільтрування сушать. Кальцію гіпохлорит менш гігроскопічний, зберігається і транспортується краще, ніж хлорне вапно, в якому баласт разом з тарою становить 250‑300 % у перерахунку на активний Сl2.
Хлоруванням розчинів NaOH виробляють стійкі розчини гіпохлориту натрію, які використовуються для вибілювання тканин, очищення стічних і питної вод, як окиснювач у кольоровій металургії, в анілінобарвниковій промисловості та ін.
Питання до розділу 13
1. Які процеси називаються електрохімічними?
2. Які сполуки отримують електролізом?
3. Від яких чинників залежить швидкість електрохімічних реакцій?
4. Що називають електрохімічним еквівалентом речовини?
5. Що називають потенціалом розкладання електроліту?
6. Сформулювати перший і другий закони Фарадея.
7. За якою формулою визначаючу рівноважні електродні потенціали?
8. Що називають коефіцієнтом використання струму?
9. Як визначають вихід речовини за струмом?
10. Як визначається фактична витрата енергії при електролізі?
11. Що називають коефіцієнтом використання енергії?
12. Які реакції відбувають на аноді і катоді при електролізі водного розчину NaCl?
13. Які продукти отримують при електролізі водного розчину NaCl?
14. Яка будова електролітичної ванни для електролізу водного розчину NaCl?
15. З яких матеріалів виготовляють аноди і катоди?
16. Як отримують хлороводень?
17. Як отримують хлоридну кислоту?

Розділ 14. ЕЛЕКТРОТЕРМІЧНІ ВИРОБНИЦТВА
14.1. Основні електротермічні закони
В електротермічних процесах електрична енергія використовується переважно для виробництва теплоти, під впливом якого відбуваються хімічні реакції. Але у багатьох випадках одночасно відбуваються та електрохімічні процеси, як, наприклад, при виробництві рідкісних, легких, лужних і лужноземельних металів.
Електротермічні розрахунки провадять на основі закону Джоуля, за яким кількість виділеної змінним струмом теплоти визначається рівнянням:
Q = 0.293 Ult соs φ,
де: U – напруга, В; I – сила струму, А; t – час, с; cos φ – коефіцієнт потужності.
Кількість теплоти, що виділяється у провіднику, залежить від електричного опору провідника R (Ом), який обчислюють за законом Ома:

Потужність печі W (Вт) визначають за таким рівнянням:
 .
.
Чим менший кут зсуву фази φ, тим ближче до одиниці значення cos φ і тим вищий ступінь перетворення електричної енергії у теплову.
Електричні печі мають ряд істотних переваг: можливість досягати високих температур у малому об'ємі печі, велику швидкість нагрівання, виділення теплоти у самому матеріалі, що підлягає нагріванню, відсутність забруднення матеріалу продуктами горіння палива, найширша можливість автоматизації процесу, високий к. к. д. установок.
Електричні печіподіляються на печі опору, дугові, комбіновані та індукційні.
У печах опору прямого нагрівання(рис. 14.1, а) провідником струму є матеріал, який підлягає обробці і має великий опір.

Рис. 14.1. Печі опору: а – прямого нагрівання; б – непрямого нагрівання
У печах опору непрямого нагрівання(рис. 14.1, б) струм проходить через дротяний, стрічковий або стрижневий провідник з великим опором і виділена при цьому теплота передається матеріалу теплопередачею або випромінюванням.
У дугових печах прямого нагріву електрична дуга утворюється між електродами у масі самого матеріалу, що нагрівається.
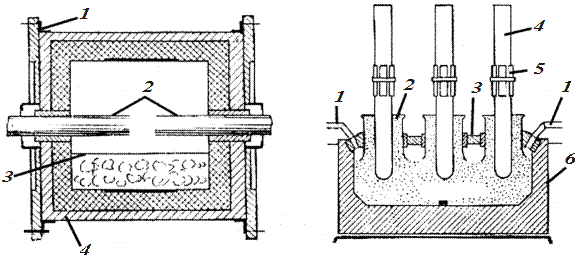
У дугових печах непрямого нагріву (рис. 14.2) електрична дуга утворюється між двома електродами і матеріал нагрівається внаслідок теплоти випромінювання. У комбінованих печах (рис. 14.3) нагрівання матеріалу здійснюється завдяки утворенню електричної дуги і внаслідок проходження електричного струму через твердий або розплавлений матеріал. Це трифазні печі змінного струму, які за своєю конструкцією, формою перетину і відповідним розміщенням електродів поділяються на круглі, еліптичні і прямокутні. У великих електричних печах електроди автоматично опускаються у міру згоряння і безперервно нарощуються без припинення роботи печі.
Електротермічні процесишироко використовують у металургійній промисловості при виробництві спеціальних сталей, феросплавів, кольорових і рідкісних металів, для добування фосфору, кальцію ціанаміду, кальцію карбіду та інших карбідів, при виплавлянні кварцового скла, кислото- і вогнетривких матеріалів та ін. Особливого значення набувають електротермічні процеси у металургії рідкісних металів для виробництва високочистих металів і сплавів, а також у технології органічного синтезу.
| |
| Рис. 14.2. Дугова піч непрямого нагрівання: 1 – кожух; 2 – електроди; 3 – матеріал, що нагрівається; 4 – теплоізоляція | Рис. 14.3. Комбінована електрична піч: 1 – труби для відсмоктування газів; 2 – отвори для завантаження матеріалу; 3 – склепіння; 4 – електроди; 5 – електродотримачі; 6 – стальний кожух |
14.2. Виробництво кальцію карбіду
Для виробництва кальцію карбіду використовується вапно, антрацит, кокс або їх суміші, які не повинні містити домішок фосфору і сірки, тому що фосфор утворює вибухо- і отруйно-небезпечний фосфін, а сірка – сірководень. Кількісне співвідношення сировинних матеріалів пов'язане з якістю добутого кальцію карбіду. Із збільшенням у шихті вуглецю збільшується літраж карбіду, але зменшується його вихід, при збільшенні у шихті вмісту вапна, навпаки, зменшується літраж карбіду.
Кальцію карбід утворюється при відновленні СаО вуглецем:
СаО + 3С = СаС2 + CO + 452 кДж.
Реакція починається при 1700‑1800 °С, але уже при 2200 °С кальцію карбід розкладається і випаровується, тому процес ведуть при температурах, близьких до 2000 °С. Процес здійснюється у великих електропечах при напрузі струму 50‑90 В. Потужність печей досягає 50 000 кВт і більше, при густині струму 10 А/см2 електрода і більше. У карбідних печах застосовують комбіноване нагрівання шихти дугою та опором, у безперервно діючих печах з електродами, які самі спікаються. Періодично через льотку з печі випускається розплавлений кальцію карбід у виливниці або обертові барабани, які ззовні охолоджуються водою. На 1 т карбіду утворюється 150‑250 м3 газу, до складу якого входить у середньому близько 65 % CO, 15 % Н2, 4 % СО2, 0,5 % О2 і решта N2. Ця газова суміш використовується у промисловості органічного синтезу або як горючий газ. На 1 т кальцію карбіду витрачається у середньому 900‑950 кг вапна, 600‑650 кг коксу, 20-40 кг електродів і 3000‑3200 кВт·год електроенергії. Кальцію карбід кристалізується у вигляді безбарвних кристалів, але технічний продукт має темно-сірий колір з різними відтінками залежно від його чистоти.
Якість кальцію карбіду визначають кількістю літрів ацетилену (літражем) при нормальних умовах, який утворюється від розкладання 1 кг кальцію карбіду. Літраж хімічно чистого кальцію карбіду становить 346,8 л/кг, а технічного – змінюється у межах 230‑280 л/кг. До останнього часу кальцію карбід був основною сировиною для добування ацетилену, який утворюється за реакцією
СаС2 + 2Н2О = С2Н2 + Са (ОН)2 + Q.
З кальцію карбіду виробляють також кальцію ціанамід та ціанід, його застосовують у металургії як розкислювач.
14.3. Виробництво кальцію ціанаміду
Кальцію ціанамід застосовують як азотне добриво та як дефоліант, наприклад для завчасного опадання листя бавовнику перед збиранням бавовни. З кальцію ціанаміду добувають також ціаніди, амоніак, диціандинамід H2C2N2, який застосовується при виробництві меламінових пластмас, вибухових речовин, фармацевтичних препаратів та ін.
Кальцію ціанамід добувають азотуванням подрібненого кальцію карбіду у печах різної конструкції за реакцією
СаС2 + N2 = CaCN2 + C + 293 кДж.
Технічний продукт чорного кольору містить, як це видно з рівняння реакції, вуглець, що виділяється у процесі реакції.
Кальцію ціанамід виробляється у печах періодичної і безперервної дії. Перші з них – це металеві циліндри, футеровані вогнетривкою цеглою, в які завантажується подрібнений кальцію карбід. У центрі маси встановлюєтеся електрод для нагрівання суміші до початку реакції при 800 °С, а далі реакція здійснюється автотермічно. Маса дуже розігрівається і приблизно через добу процес закінчується. Після охолодження з печі виймають гарячий блок чорного кальцію ціанаміду, який подрібнюють, добавляють до нього води для розкладання залишків кальцію карбіду, обробляють олією, щоб ціанамід не розпилювався, і відправляють на склад.
Печі безперервної дії є канальними або тунельними печами. Це довгий канал з рейками, в одному напрямку якого повільно рухаються платформи з карбідом, а у протилежному пропускається N2. У зоні нагрівання відбувається азотування, яке закінчується під час руху платформи. Платформа виходить з каналу з застиглим блоком ціанаміду.
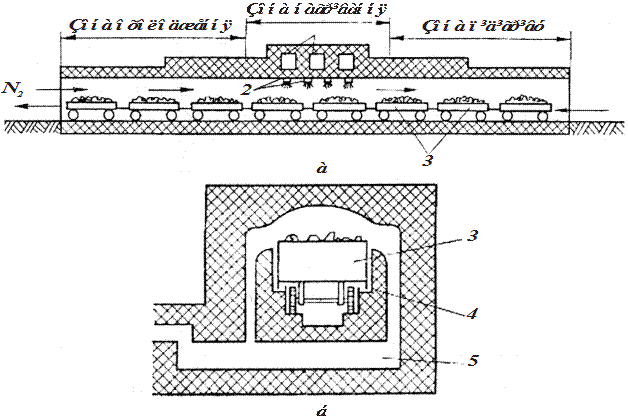
Рис. 14.4. Поздовжній (а) і поперечний (б) розріз тунельної печі: 1 – канали для подачі повітря до пальників; 2 – пальники; 3 – вагонетки з виробами; 4 – закрив з піску;
5 – димохід
14.4. Виробництво фосфору і фосфатної кислоти
Важливе місце серед електротермічних процесів посідає електротермічна сублімація фосфору з природних фосфатів. Цей спосіб полягає у тому, що при 1500–1600 °С SiO2 заміщує Р2О5 в його сполуках, а наявний тут вуглець відновлює Р2О5 до фосфору.
Сублімація фосфору здійснюється в електропечах або у печах типу домен, куди завантажується суміш з кусків фосфату, піску або подрібненого кварцу і коксу чи антрациту. При відповідній температурі відбувається процес сублімації який можна зобразити такою сумарною реакцією:
2Ca3(PO4)2 + nSiO2 + 10С = Р4 + 10СО + 6СаО ∙ nSiO2 – Q.
Залежно від складу шихти значення п змінюється від 4 до 7. При п=6 реакція відбувається з поглинанням 3557 кДж теплоти на 1 моль Р4.
Крім основної реакції у печі відбуваються також реакції відновлення заліза: