 |
|
Химические свойства алкиламинов
4.1. Кислотно-основные свойства. Амины являются основаниями, образующими при взаимодействии с протонными кислотами аммонийные соли. Основность аминов можно охарактеризовать величиной константы диссоциации сопряженной кислоты – аммонийной соли Ка или ее –lg Ка = рКa, при этом, чем больше значение рКa, тем выше основность. Ниже приведены значения рКа для аммиака и некоторых наиболее распространенных аминов.
Основание рКа
Аммиак 9.25
Метиламин 10.66
Диметиламин 10.73
Диизопропиламин 11.13
Триметиламин 9.81
Анилин 4.63
N-Метиланилин 4.85
1,8-бис(Диметиламино)нафталин 12.37
Рассмотрим влияние xарактера и числа заместителей у атома азота на основность аминов. Сравним основность аммиака, метиламина, диметиламина и триметиламина. Поскольку метильная группа является донором электронов по индуктивному эффекту, ее влияние сводится к тому, что неподеленная пара электронов азота становится более «диффузной», т. е. располагается дальше от ядра атома азота и, следовательно, более доступна для атаки электрофилом, в том числе и протоном. Кроме того, индуктивный эффект алкильного заместителя стабилизирует протонированную форму амина. Из этого следует, что с ростом числа алкильных заместителей у атома азота основность амина возрастает, что и наблюдается в действительности для газовой фазы и с некоторыми оговорками для растворов.

в неводных растворах или газовойфазе

Однако увеличение количества заместителей у атома азота приводит к заметному снижению эффективности сольватации протонированной формы амина. В связи с этим третичные амины в протонных растворителях являются несколько более слабыми основаниями, чем вторичные.

Акцепторные заместители, связанные с атомом азота, снижают основность амина. Наиболее ярко это явление проявляется в том случае, когда заместитель является акцептором и по мезомерному эффекту. Так, амиды, которые можно рассматривать как ацильные производные аминов, вообще не обладают сколько-нибудь выраженной основностью. Причиной этого является сопряжение неподеленной пары электронов атома азота с π-системой карбонильной группы, что можно представить следующими резонансными структурами:


По той же причине ароматические амины являются более слабыми основаниями, чем алифатические. Заряд в катионе анилиния, локализован исключительно на атоме азота и, следовательно, в этом катионе отсутствует резонансная стабилизация.
Амины, имеющие хотя бы один протон у атома азота, обладают слабыми кислотными свойствами. Кислотность водородных соединений элементов внутри одного периода увеличивается слева на право, следовательно, связь N–H диссоциирует на протон и анион легче, чем связь С–Н, но труднее, чем связь О–Н, т. е. амины являются более слабыми кислотами, чем спирты, но более сильными, чем углеводороды. Аммиак, например, способен реагировать в некоторых условиях с металлическим натрием с образованием соли – амида натрия. Амид-анион является очень сильным основанием и количественно гидролизуется водой и спиртами.
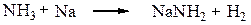

Рассмотрим, как влияют заместители на кислотность связи N–H.
Для оценки кислотности различных соединений необходимо сравнивать устойчивости их анионов. При этом акцепторные заместители, стабилизирующие отрицательный заряд, повышают устойчивость и соответственно кислотность, а донорные проявляют обратный эффект. Поэтому метиламин является более слабой кислотой, чем аммиак, а диметиламин – чем метиламин. Соответственно основность анионов изменяется в обратном порядке:
(СН3)2N– > (CH3)HN– > NH2–.
Одним из самых сильных органических оснований, используемых в органическом синтезе, является диизопропиламид лития (LDA), который получают взаимодействием диизопропиламина с литийорганическими соединениями, например с фениллитием.

Изопропильные группы как донорные заместители повышают основность аниона и обеспечивают его пространственное экранирование. Вследствие этого LDA является сильным основанием, но слабым нуклеофилом, позволяющим количественно превращать СН-кислоты (например, карбонильные соединения, содержащие атомы водорода у α-углеродного атома) в анионы.

Нуклеофильное присоединение этого основания по кратным связям при этом не происходит.
Ацепторные группы, присоединенные к атому азота, напротив, повышают NH-кислотность, поскольку стабилизируют образующийся при депротонировании анионный центр. Так, амиды являются достаточно сильными NH-кислотами, что связано с резонансной стабилизацией соответствующего аниона.

Две карбонильные группы в молекуле фталимида в еще большей степени стабилизируют отрицательный заряд, вследствие чего это соединение является более сильной кислотой, чем вода. Это позволяет получать фталимид калия, используемый в синтезе аминов по Габриэлю, взаимодействием фталимида с KOH в водном растворе.
4.2. Взаимодействие с электрофильными реагентами. Амины из-за наличия неподеленной электронной пары атома азота являются нуклеофилами. Поэтому они способны реагировать с электрофилами, такими как катионы металлов с вакантными d-орбиталями, кислотами Льюиса, а также различными С-, N-, О-, галоген- и S-электрофилами.
4.2.1. Взаимодействие аминов с С-электрофилами.
4.2.1.1. Ацилирование. Первичные и вторичные амины реагируют с хлорангидридами карбоновых кислот с образованием амидов. Для полного расходования ангидрида необходимо применять двукратный избыток амина, так как один эквивалент последнего превращается в гидрохлорид, не являющийся нуклеофилом. Ацилирование хлорангидридами ароматических карбоновых кислот, например хлористым бензоилом, часто проводят в водном растворе в присутствии щелочи (ацилирование по Шоттен–Бауману). Если амин является менее доступным, чем хлорангидрид, реакцию ацилирования проводят в присутствии органического основания, например третичного амина или пиридина, которые связывают выделяющийся хлороводород. Кроме того, третичный амин выполняет в этой реакции и функцию катализатора, поскольку будучи нуклеофилом он также способен реагировать с хлорангидридом карбоновой кислоты. Но эта реакция является обратимой, так как в образующейся молекуле находится аммонийная группа, которая является более хорошей уходящей группой, чем хлор. Поэтому этот аддукт является более эффективным ацилирующим агентом, чем исходный хлорангидрид.

Амиды легко образуются также при взаимодействии первичных и вторичных аминов с ангидридами карбоновых кислот и несколько более медленно также при взаимодействии со сложными эфирами.
Для разделения смесей первичных, вторичных и третичных аминов используется реакция с другим хлорангидридом – пара-толуолсульфохлоридом. Поскольку в синтезе аминов довольно часто образуются именно такие смеси, этот метод имеет определенное препаративное значение. Первичный и вторичный амины при взаимодействии с пара-толуолсульфохлоридом образуют сульфамиды, третичные амины амидов не образуют и, следовательно, могут быть отделены. Сульфамид, образующийся из первичного амина, содержит у атома азота протон, и, поскольку сульфогруппа представляет собой сильный акцептор, сульфамид является достаточно сильной NH-кислотой, чтобы растворяться в водных растворах щелочей.
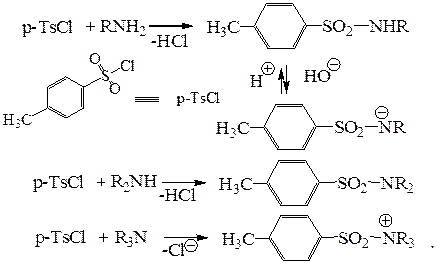
Таким путем удается разделить смесь сульфамидов, из которых исходные амины выделяют щелочным гидролизом.
4.2.1.2. Реакции аминов с альдегидами и кетонами. Первичные амины в реакциях с альдегидами или кетонами выступают в роли нуклеофильных реагентов, которые атакуют карбонильную группу. В результате реакции образуются имины (альдимины или кетимины). Реакция катализируется кислотами, протекает по механизму присоединения-отщепления и является обратимой. Для того чтобы реакция проходила до конца, необходимо удаление из реакционной среды образующейся воды. В водных растворах кислот имины легко гидролизуются с образованием исходных соединений


На первой стадии происходит протонирование карбонильной группы, затем следует нуклеофильная атака неподеленной парой атома азота электрофильного углеродного атома с образованием протонированного аминокарбинола. В случае третичных аминов реакция дальше происходить не может, кроме обратного превращения. В случае первичных аминов далее происходит обратимый перенос протона на атом кислорода, после чего быстро отщепляется молекула воды с образованием резонансно-стабилизированного катиона, отщепление протона от которого приводит к имину.
При введении в эту реакцию вторичных аминов происходит отщепление протона от α-углеродного атома с выделением енаминов .

4.2.1.3. Реакции аминов с карбенами. В качестве электрофила по отношению к первичным аминам может выступать дихлоркарбен, который генерируют взаимодействием хлороформа со щелочью. Образующиеся в этой реакции соединения называются изонитрилами, они обладают очень сильным неприятным запахом, очень ядовиты.

Прежде эту реакцию использовали как качественную для определения аминов и хлороформа(изонитрильная проба).
4.2.2. Взаимодействие аминов с N-электрофилами. Нитрозирование – реакция с HNO2.При взаимодействии первичных аминов с азотистой кислотой образуются крайне неустойчивые алифатические соли диазония. На первой стадии нитрозоний-катион как электрофил, атакует неподеленную пару электронов атома азота, и после отщепления протона образуется N-нитрозопроизводное. Далее происходит перенос протона от атома азота к атому кислорода с образованием диазогидрата. После протонирования атома кислорода и отщепления воды образуется крайне неустойчивый алифатический диазониевый катион, который тут же разлагается либо при взаимодействии с растворителем (бимолекулярный процесс), либо мономолекулярно с элиминированием азота и образованием карбокатиона. Последний далее с выбросом протона превращается в алкен, или реагирует с имеющимися в среде нуклеофилами, например с растворителем, с образованием спирта или галогеналкана.

При взаимодействии вторичных аминов с азотистой кислотой образуются N-нитрозоамины, например из диметиламина образуется N-нитрозодиметиламин.
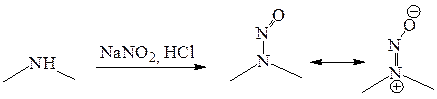
N-Нитрозоамины обладают высокими дипольными моментами, что иллюстрируется резонансной структурой с разделенными зарядами. Это обусловливает их физические свойства. К примеру, N-нитрозодиметиламин обладает достаточно высокой температурой кипения (152-153 оС), хорошо растворим в воде, при этом метильные группы в его молекуле неэквивалентны (порядок связи N-N больше 1 и вращение вокруг нее затруднено). Физические свойства этого вещества обусловили его использование в качестве апротонного диполярного растворителя для проведения реакций нуклеофильного замещения SN2 до тех пор, пока не обнаружили, что все N-нитрозоамины, содержащие хотя бы один атом водорода у α-углеродного атома, включая N-нитрозодиметиламин, являются очень мощными канцерогенами (вызывают появление злокачественных новообразований). Сам N-нитрозодиметиламин в настоящее время используется в качестве эталона для оценки канцерогенности других веществ. N-Нитрозоамины могут образовываться в пищевых продуктах (рыба, мясо, птица) при копчении, поэтому их концентрация в продуктах строго контролируется. Одним из методов анализа является отделение нитрозоаминов и перевод их в соответствующие амины путем гидролиза. Сами амины в очень низких концентрациях (допустимых для примесного содержания нитрозоаминов) количественно определяются дансильным методом путем их превращения в соответствующие сульфамиды, которые обладают флуоресценцией и легко детектируются.  Алифатические третичные амины также реагируют с азотистой кислотой, однако в этом случае образуется сложная смесь продуктов, включающая продукты распада связи С–N.
Алифатические третичные амины также реагируют с азотистой кислотой, однако в этом случае образуется сложная смесь продуктов, включающая продукты распада связи С–N.

4.2.3. Реакции с О-электрофилами. Как алифатические, так и ароматические амины весьма лабильны по отношению к окислителям. Направление реакции существенным образом зависит как от структуры исходного амина, так и от природы окислителя.
4.2.3.1. Окисление перманганатом калия. Перманганат калия окисляет первичные амины в нитросоединения. Эта реакция идет с высоким выходом только в том случае, когда аминогруппа находится у третичного атома углерода.

4.2.3.2. Окисление H2O2. При окислении третичных аминов пероксидом водорода образуются N-окиси аминов.

Эти соединения представляют интерес тем, что легко претерпевают термическое элиминирование по Коупу. Реакция протекает как синхронный процесс через циклическое переходное состояние с образованием смеси алкенов.

Соотношение продуктов – статистическое: пропорционально количеству атомов водорода у β-углеродного атома; при этом транс-изомера образуется больше, чем цис-алкена.
Вторичные амины под действием Н2О2 превращаются в диалкилгидроксиламины также через промежуточные N-оксиды.
