 |
|
Химические свойства ариламинов
Напомним, что в ариламинах амногруппа непосредственно связана с бензольным кольцом.
5.1 Основность. Эти амины имеют значительно меньшую основность, чем алифатические амины и аммиак: рКа метиламина 10,6, рКа анилина 4,6 (в воде). Пониженная основность ароматических аминов объясняется сопряжением электронной пары атома азота в ароматических аминах с бензольным кольцом. При этом атом азота находится в sp2 гибридном состоянии (а не в sp3 как в алифатических аминах). +М эффект аминогруппы вызывает понижение электронной плотности на атоме азота.

Кроме того, при протонировании по атому азотааминов электронная пара связывается с протоном и выводится из сопряжения с ароматическим циклом, что энергетически невыгодно.

Наличие электроноакцепторных заместителей в ароматическом кольце амина еще более снижает его основность.
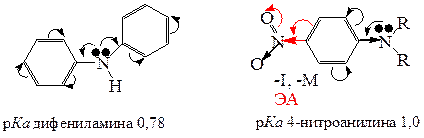
Если в ароматическом кольце присутствуют электронодонорные заместители то, они способствуют повышению основности ароматических аминов. В общем виде можно представить ряд измененияосновности ароматических аминов следующим образом:
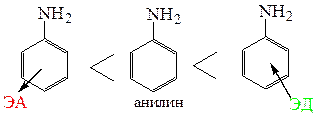
С учетом того, что алифатические амины являются более сильными основаниями, чем аммиак, получаем следующий ряд изменения основных свойств при переходе от ароматических к алифатическим аминам:

5.2. Реакции с электрофильными реагентами. Химические свойтва ароматических аминов определяются наличием электронной пары на атоме азота, полярностью связей С-N и N-H, а также влиянием аминогруппы на ароматическое кольцо.
Реакции с электрофильными реагентами могут идти как по аминогруппе, так и по ароматическому кольцу, так как присутствие аминогруппы значительно активирует ароматический цикл к реакциям SE, поскольку эта пара электронов находится в сопряжении с бензольным кольцом (+M >> -I, ЭД). Электронная плотность с атома азота в определенной степени делокализована (соответственно она уменьшается на атоме азота), а в орто- и пара-положениях бензольного кольца анилина электронная плотность повышена.
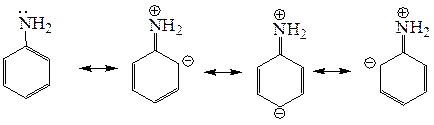
В условиях кинетического контроля электрофильная атака, например протонирование, происходит по положению с максимальной электронной плотностью – по атому азота. Процесс, идущий по π-системе кольца, имеет большую энергию активацию, так как в этом случае происходит нарушение ароматичности системы при образовании σ-комплекса.
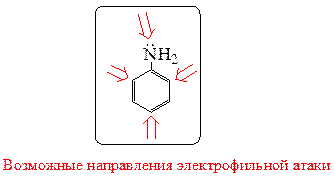
Таким образом, в реакциях анилина с электрофильными реагентами во всех случаях следует в первую очередь ожидать образования продуктов электрофильной атаки по атому азота, и только в том случае, если эти продукты оказываются неустойчивыми в условиях проведения реакции, выделяются продукты, являющиеся результатом электрофильной атаки в кольцо.
5.2.1. Реакции с С-электрофилами
5.2.1.1. Алкилирование. Алкилирование анилина и его производных алкилгалогенидами происходит исключительно по атому азота с образованием преимущественно моно-N-алкилированных анилинов. То, что алкилирование ароматических аминов происходит более селективно, чем алифатических, связано с более низкой нуклеофильностью этих соединений, вызванной сопряжением неподеленной пары атома азота с π-системой ароматического кольца. Применение избытка алкилгалогенида в присутствии основания позволяет получать ди- и триалкилированные производные.
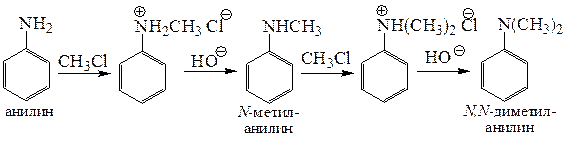
Для алкилирования анилина с образованием N,N-диалкиланилинов может быть использована кислотно-катализируемая реакция с низшими спиртами.
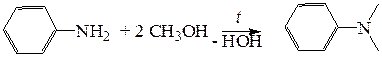
5.2.1.2. Ацилирование. Ацилирование производных анилина галогенангидридами или ангидридами карбоновых кислот при наличии хотя бы одного протона у атома азота также происходит по атому азоту. Реакция происходит без катализатора – кислоты Льюиса, и приводит исключительно к продукту моно-N-ацилирования.
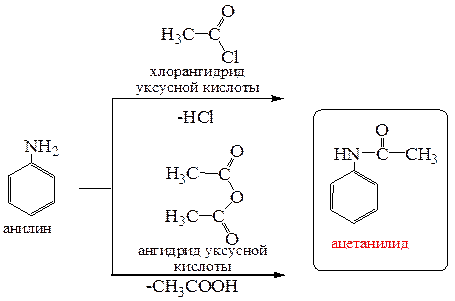
Полученное ацетамидное производное при наличии протона у азота обладает повышенной NH-кислотностью и под действием сильных оснований, например NaNH2, превращается в анион, который способен реагировать только с одним молем алкилгалогенида с образованием N-алкилированного ацетамидного производного.
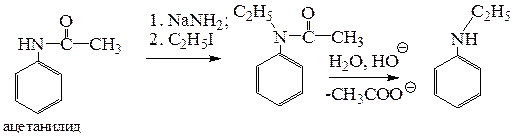
Гидролиз последнего в щелочной среде позволяет получить продукт моноалкилирования исходного анилина без примеси продуктов полиалкилирования.
5.2.2. Галоидирование. Галоидирование анилина и его производных происходит при действии галогенов (хлора, брома) и не требует катализатора. Более того, поскольку аминогруппа является исключительно сильным донорным заместителем, даже в очень мягких условиях удается получать только 2,4,6-тригалогенанилины. Реакция используется как качественная на первичные ароматические амины.

Для получения моногалогенпроизводного необходимо понизить донорные свойства аминогруппы в молекуле ароматического амина превращением его в ацетамидное производное. Для получения 4-броманилина анилин превращают в ацетанилид, далее ацетанилид бромируют бромом без катализатора и на последней стадии гидролизом ацетамидной группы «снимают защиту с аминогруппы».
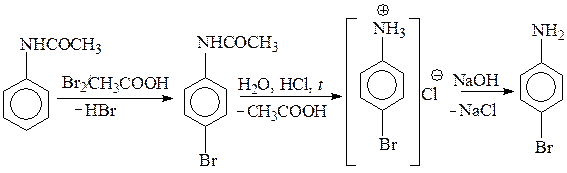
Бромирование диметиланилина также происходит без катализатора преимущественно в пара-положение вследствие стерических препятствий, создаваемых соседней объемной группой при орто-атаке. В реакции монобромирования диметиланилина используют как правило его двукратный избыток, при этом 1 моль субстрата расходуется на связывание выделяющегося бромистого водорода.
В отличие от бензола, анилин может быть подвергнут прямому иодированию в кольцо. Реакция анилина с I2 протекает в воде в гетерогенной среде. Для связывания выделяющейся иодистоводородной кислоты используют соду.

Низкая активность реагента и его большой объем обуславливают образование преимущественно п- изомера.
5.2.3. Реакция с S-электрофилами. Реакция сульфирования анилина происходит при действии концентрированной серной кислоты в достаточно жестких условиях. При смешении реагентов сначала происходит протонирование аминогруппы и образуется соль – гидросульфат анилиния. Эту соль нагревают при высокой температуре (200 °С). Полагают, что при этом первоначально происходит сульфирование по атому азота с образованием продукта кинетического контроля. Вероятно, реакция вообще происходит потому, что в смеси присутствует незначительное количество непротонированного анилина, поскольку только он может выступать в роли нуклеофила. Далее происходит кислотно–катализируемая перегруппировка, приводящая к миграции сульфогруппы в кольцо с образованием сульфаниловой кислоты.
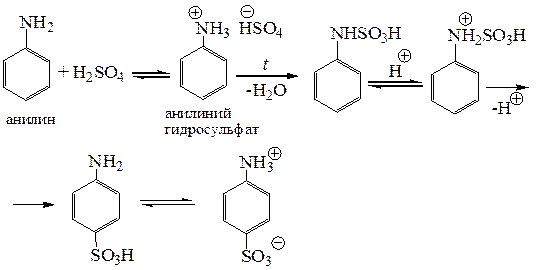
Иной способ получения сульфаниловой кислоты заключается во
взаимодействии ацетанилида с хлорсульфоновой кислотой, которое происходит в мягких условиях с образованием соответствующего сульфохлорида. Последующий гидролиз приводит к сульфаниловой кислоте.

При взаимодействии сульфохлорида с аммиаком происходит образование амида сульфаниловой кислоты, известного под названием «белый стрептоцид» – одного из первых синтетических антимикробных препаратов.
Биологическая активность сульфаниламида обуславливается сходством его структуры со структурой пара-аминобензойной кислоты, которая необходима для роста и размножения микроорганизмов. Основной механизм действия сульфаниламида и родственных ему сульфамидных препаратов заключается в конкуренции с пара-аминобензойной кислотой за связывание с определёнными ферментами в микробной клетке. В результате взаимодействия сульфаниламида с ферментами бактерии теряют способность синтезировать фолиевую кислоту и осуществлять другие превращения, для которых необходима пара-аминобензойная кислота.
При взаимодействии α-диметиламинонафталина с олеумом происходит сульфирование субстрата по положению 5. Обработка образовавшейся сульфокислоты пятихлористым фосфором ведет к соответствующему сульфохлориду – дансилхлориду, который, как упоминалось выше, используется для определения аминов переводом их во флуоресцирующие производные.
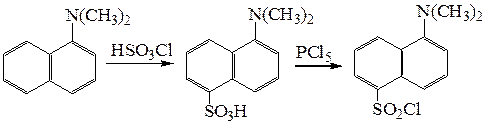
5.2.4. Реакции с N-электрофилами.
5.2.4.1 Нитрование. Амины, в том числе и ароматические, весьма чувствительны к окислению, а азотная кислота является сильным окислителем, поэтому прямое нитрование анилина с участием азотной кислоты осуществить невозможно. В этом случае также необходимо использование защитной ацильной группы. Нитрование ацетанилида происходит при действии нитрующей смеси и приводит к смеси орто-изомера (10 %) и пара-изомера (90 %). Щелочной гидролиз продуктов нитрования позволяет получить целевые орто- и пара-анилины.

Интересно, что нитрование ацетанилида смесью азотной кислоты с уксусным ангидридом приводит к обратному соотношению изомеров – орто-изомера образуется 70 %. Уксусный ангидрид в этой реакции выступает не просто как растворитель – происходит его взаимодействие с азотной кислотой с образованием ацетилнитрата – смешанного ангидрида уксусной и азотной кислот.
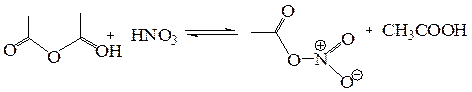
Такие условия нитрования используют для других активных аренов (содержащих сильные донорные заместители) и π-избыточных гетероциклов, чувствительных к кислым средам.
5.2.4.2. Нитрозирование вторичных и третичных ароматических аминов. Нитрозоний-катион является слабым электрофилом, но поскольку диалкиламиногруппа является сильным донором электронов, при взаимодействии, например, диметиланилина с азотистой кислотой происходит нитрозирование, которое идет в пара-положение с образованием нитрозопроизводного. Поскольку реакция происходит в кислой среде, то продукт образуется в виде соли, которая существует в хиноидной таутомерной форме.
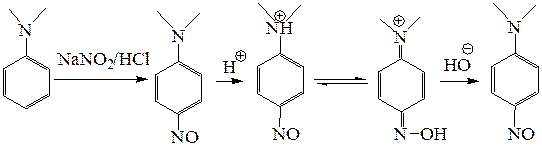
Нейтрализация этой соли приводит к свободному основанию – 4-нитрозо-N,N-диметиланилину. Следует отметить, что при нагревании этой соли в водном растворе происходит образование диметиламина и пара-нитрозофенола. Эти две реакции (нитрозирование и гидролиз) используются для идентификации третичных жирно-ароматических аминов.
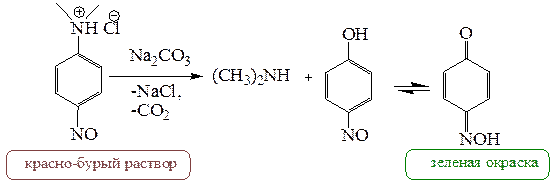
Последнее превращение можно рассматривать также как способ получения диметиламина без примесей других аминов.
Нитрозирование моно-N-замещенных анилинов азотистой кислотой приводит к образованию N-нитрозопроизводного – продукта кинетического контроля, который при нагревании изомеризуется в пара-замещенный изомер.

Реакция первичных ароматических аминов с азотистой кислотой будет рассмотрена ниже.
5.2.5. Взаимодействие с О-электрофилами – реакции окисления. Как и алифатические, ароматические амины достаточно лабильны по отношению к окислителям. Строение продуктов окисления существенным образом зависит от структуры субстрата и природы окислителя. Так, при окислении анилина карбоновыми надкислотами может быть получен нитрозобензол и далее –нитробензол.
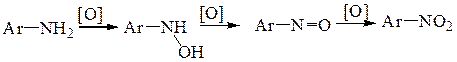
Окисление анилина кислородом воздуха в присутствии однохлористой меди приводит к азобензолу, а при окислении пероксидом водорода образуется азоксибензол.

При окислении анилина бихроматом калия или перманганатом калия конечным продуктом является п-бензохинон, структурной особенностью которого является наличие так называемой «хиноидной структуры». Реакция протекает через образование ряда промежуточных продуктов окисления:

Окисление анилина перманганатом или бихроматом калия в кислой среде приводит к сложной смеси продуктов, из которой с небольшими выходами можно выделить бензохинон и семидин. Однако главным образом в этих условиях образуется краситель, так называемый анилиновый черный, представляющий собой смесь полимерных продуктов, не установленной до конца структуры.
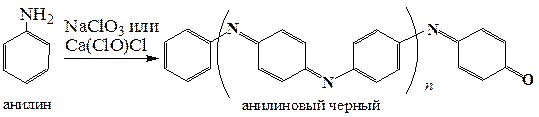
Последовательным действием на анилин хлоратом натрия, а затем бихроматом калия получают краситель анилиновый черный, используемый для приготовления чернил для заправки картриджей.
6. Некоторые практически важные амины.
Этилендиамин получают в промышленном масштабе взаимодействием аммиака с дихлорэтаном, применяют в производстве фунгицидов, красителей, стабилизаторов латексов, эмульгаторов, пластификаторов и др., как отвердитель эпоксидных смол. При взаимодействии этилендиамина с хлоруксусной кислотой образуется этилендиаминтетрауксусная кислота, которую используют в качестве комплексона.
Путресцин (от лат. – разлагающийся) – 1,4-диаминобутан и кадаверин (от лат. cadaver – труп), 1,5-диаминопентан содержатся в продуктах гнилостного распада белков. Они образуются при декарбоксилировании бактериями аминокислот.
Гексаметилендиамин (1,6-диаминогексан) важнейший полупродукт в производстве полиамидного волокна, используется также как отвердитель эпоксидных смол. Мировое производство гексаметилендиамина достигает нескольких сотен тысяч тонн в год. Распространённый промышленный метод получения этого соединения – восстановление динитрила адипиновой кислоты водородо на катализаторах, чаще медно-кобальтовых. Поликонденсация гексаметилендиамина с адипиновой кислотой ведет к полиамиду, который называется найлон-6,6 и широко используется в производстве синтетических волокон.
Биогенные амины. К биогенным аминам относятся природные соединения растительного происхождения. Эти соединения легко экстрагируются из растительного сырья водными растворами кислот, а затем выделяются в чистом виде при подщелачивании экстрактов. Основные свойства аминов послужили причиной их названия – «алкалоиды» (от англ. «alkali-like»). В настоящее время известно более 5 тысяч алкалоидов. Большая их часть характеризуется высокой биологической активностью.
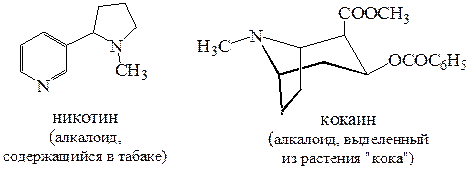
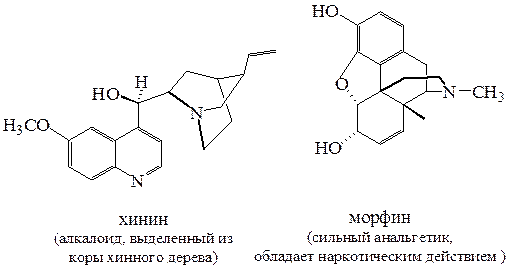
Некоторые биогенные амины вырабатываются живыми организмами и играют важную роль в биохимических процессах. Такие амины известны в биологии животных как нейромедиаторы. Эти соединения обеспечивают передачу нервного сигнала.
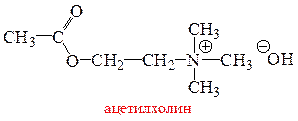

Норадреналин является предшественником адреналина и считается одним из важнейших «медиаторов бодрствования». По химическому строению норадреналин отличается от него отсутствием метильной группы у атома азота аминогруппы боковой цепи, его действие как гормона во многом синергично с действием адреналина.
Вегетативная нервная система работает при участии аминов. Место контакта одной нервной клетки с другой или с исполнительным органом называется синапсом. В этом месте при поступлении нервного сигнала и выделяется нейромедиатор – посредник, который реализует соответствующий контакт и передачу нервного сигнала. В синапсах парасимпатической нервной системы выделяется ацетилхолин, в синапсах симпатической нервной системы – норадреналин. Объемы выделяемых нейромедиаторов (называемых также нейротрансмиттерами) невелики. Ацетилхилин выделяется, например, дозами, каждая из которых содержит около 10 000 молекул. Эти молекулы распределяются по синаптической щели так, что сигнал достигает рецептора. Воздействие ацетилхолина на рецептор вызывает соответствующий физиологический ответ, после чего нейромедиатор подвергается разрушению. К примеру, ацетилхолин гидролизуется под действием фермента ацетилхолинэстеразы (АХЭ): 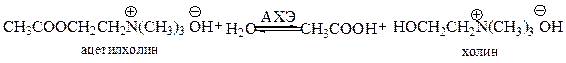
При нормальном функционировании нервной системы гидролиз «отработавшего» ацетилхолина должен происходить в течение нескольких миллисекунд. Последнее является непременным условием принятия следующего нервного импульса.
Нейротоксины блокируют действие ацетилхолина.
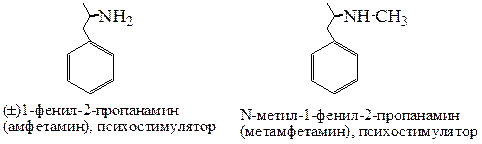
Амфетамин (сокр. от α-метилфенилэтиламин), как и метамфетамин, являются стимуляторами центральной нервной системы, производными фенилэтиламина. Механизм действия основан на выбросе нейромедиаторов (дофамина и норадреналина). Амфетамин является популярным психоактивным веществом, способным вызывать психологическую зависимость. Оборот амфетамина ограничен международным и национальным законодательствами.
Метилендиоксиметамфетамин (MDMA) (3,4-метилендиокси-N-метамфетамин) — полусинтетическое психоактивное соединение амфетаминового ряда, относящееся к группе фенилэтиламинов, известное под сленговым именем «экстази». MDMA имеет уникальную психоактивную характеристику ввиду своей способности вызывать чувства эйфории, интимной близости и доверия, а также снижать чувства страха и беспокойства. Эти эмоциональные эффекты имеют очень устойчивое проявление, выделяя MDMA среди других стимуляторов и психоделиков в отдельную группу эмпатогенов.

MDMA входит в число наиболее популярных нелегальных наркотиков. Он криминализирован законами отдельных стран и международными конвенциями: производство, хранение, транспортировка и распространение MDMA является уголовным преступлением в большинстве стран мира.