 |
|
Синтез солей арилдиазония.
Основным методом синтеза солей арилдиазония является реакция диазотирования. Реакция диазотирования – взаимодействие ароматического амина с нитритом натрия в избытке минеральной кислоты при температуре от 0 до + 5º С. Реакция протекает по общему уравнению:

Один эквивалент кислоты расходуется на взаимодействие с амином, второй реагирует с нитритом натрия, выделяя азотистую кислоту. Азотистая кислота, выделяющаяся в процессе диазотирования, не является самостоятельным диазотирующим агентом, так как положительный заряд на атоме азота компенсируется положительным мезмерным эффектом гидроксильной группы. Каталитическое действие минеральных кислот заключается в переводе азотистой кислоты в одну из активных диазотирующих форм:

В растворе соляной кислоты образуется нитрозилхлорид:

В избытке органических кислот образуются нитрозоацилаты, при диссоциации которых возможно образование катиона нитрозония:

В слабокислых средах диазотирующим агентом является малоактивный триоксид азота, образующийся или из азотистой кислоты, или при взаимодействии иона нитрозоацидия с нитрит-ионом:

Диазотирующие частицы располагаются в порядке уменьшения электрофильной активности следующим образом:
 .
.
Механизм реакции диазотирования может быть представлен следующей схемой:
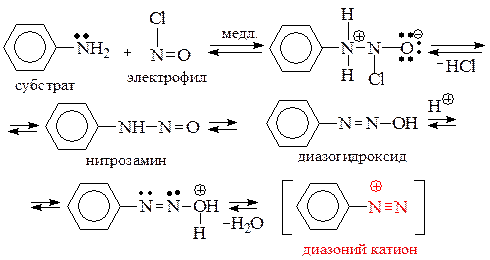
Скорость реакции диазотирования определяется скоростью атаки атома азота аминогруппы диазотирующей частицей. Образующийся промежуточный нитрозамин перегруппировывается в диазогидроксид, после протонирования которого по атому кислорода и последующего отщепления воды, получается катион диазония, который с анионом минеральной кислоты дает соль диазония.
Условия реакции диазотирования и контроль за ходом реакции.
Реакцию диазотирования проводят в сильно кислой среде. Кислота необходима, во-первых, для выделения азотистой кислоты из нитритов, во-вторых, для получения активного нитрозирующего агента, в-третьих, для предотвращения побочных реакций. Концентрация минеральной кислоты должна соответствовать основности диазотируемого амина. Амины высокой и средней основности (анилины, нафтиламины, бензидин, мононитроанилины, сульфопроизводные аминов) диазотируют в водной среде в присутствии 2-3 моль минеральной кислоты на 1 моль амина. Амины низкой основности (ди- и тринитроанилины, дихлорнитроанилин) способны реагировать только с наиболее активными диазотирующими агентами, поэтому их диазотируют в концентрированной серной кислоте или в смеси концентрированной азотной кислоты и пиросульфита калия:
K2S2O5 + 2 HNO3 → K2S2O7 + 2 HNO2.
Диазотирование орто- и пери-диаминов (например, орто-фенилендиамина или 1,8-диаминонафталина), приводит к образованию циклических диазоаминосоединений – азиминов, а в случае орто- аминофенолов – бензооксодиазолов.
Реакцию диазотирования проводят при низкой температуре (0-5 ºС), так как диазосоединения неустойчивы, при повышении температуры распадаются. Термически неустойчива и сама азотистая кислота, присутствующая в реакционной смеси.
Побочные реакции при диазотировании.
При диазотировании ароматических аминов может протекать ряд
побочных реакций.
1. Недостаток кислоты приводит к увеличению концентрации свободного амина, который может вступать в реакции азосочетания или электрофильного замещения с уже образовавшимся катионом диазония. Азосочетание идет по атому азота первичного амина:
 ,
,
а электрофильное замещение в пара-положение по отношению к аминогруппе:

Для предотвращения этих побочных реакций диазотирование ведут с такой скоростью, чтобы в растворе не было избытка свободного амина и постоянно присутствовал диазотирующий агент.
2. Происходит гидролиз солей диазония, приводящий к образованию фенолов.

Скорость реакции возрастает при повышении температуры. Реакция сопровождается выделением газообразного азота:
3. При несоблюдении температурного режима реакции азотистая кислота может разлагаться с образованием оксидов азота:
2 HNO2 = NO2 + NO + H2O.
Разложение азотистой кислоты ведет к снижению концентрации диазотирующего агента, что активизирует протекание других побочных процессов.