 |
|
Их изменение в самопроизвольных процессах
Термодинамическими потенциалами (характеристическими функциями) являются термодинамические функции, с помощью которых и их частных производных можно выразить в явном виде все термодинамические свойства системы.
Термодинамическим потенциалом называют функцию состояния, убыль которой в обратимо протекающем процессе при постоянстве определенных параметров равна максимальной полезной работе.
Наибольшее значение имеют два основных термодинамических потенциала: энергия Гельмгольца F (T, V) и энергия Гиббса G (T, p). В скобках указаны параметры, функциями которых являются термодинамические потенциалы.
Рассмотрим соответствующие процессы.
Изохорно-изотермический процесс (V, T = const).
Критерием направления процесса является изменение свободной энергии Гельмгольца:
F = U – TS. (1.18)
Объединенное уравнение первого и второго начал термодинамики имеет вид
 , (1.19)
, (1.19)
если совершается только работа расширения, то
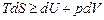 . (1.20)
. (1.20)
Знак "=" относится к обратимым процессам, а знак ">" – к необратимым.
После подстановки значения dU, полученного при дифференцировании (1.18), уравнение (1.20) запишется
 .
.
При постоянных T и V (dT = 0, dV = 0)
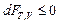 .
.
При постоянных температуре и объеме самопроизвольно могут протекать процессы, сопровождающиеся уменьшением энергии Гельмгольца. Минимум энергии Гельмгольца достигается при равновесии.
С учетом уравнения (1.19)
 .
.
Таким образом, работа в равновесном процессе равна убыли свободной энергии Гельмгольца.
Изобарно-изотермический процесс (p, T = const).
Критерием направления процесса является изменение свободной энергии Гиббса
G = H – TS, (1.21)
где H = U + pV.
После подстановки значения dU, полученного при дифференцировании (1.21), уравнение (1.20) примет вид
 .
.
Так как dT = 0, dP = 0, то
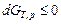 .
.
При постоянных температуре и давлении самопроизвольно могут протекать процессы, сопровождающиеся уменьшением энергии Гиббса. Минимум энергии Гиббса достигается при равновесии.
С учетом уравнения (1.19)
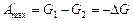 .
.
Таким образом, работа в равновесном процессе равна убыли свободной энергии Гиббса.
Рассчитав  или
или  химической реакции, можно, не проводя эксперимента, оценить возможность ее осуществления:
химической реакции, можно, не проводя эксперимента, оценить возможность ее осуществления:
DG < 0 – реакция самопроизвольно идет в прямом направлении;
DG = 0 – система находится в равновесии;
DG > 0 – реакция в прямом направлении невозможна.
Рассмотрим расчет изменения функций F и G для реакций на примере энергии Гиббса.
Изменение свободной энергии Гиббса вычисляют по уравнению Гиббса-Гельмгольца
 , (1.22)
, (1.22)
в котором тепловой эффект рассчитывают с помощью стандартных энтальпий образования, а стандартное изменение энтропии – по абсолютным энтропиям участников реакции по уравнениям (1.7) и (1.16). При температуре, отличной от 298 К, учитывают зависимость Dср = f(T) для каждого реагента и уравнения (1.11) и (1.17).
Расчет 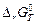 часто проводят по уравнению Темкина-Шварцмана
часто проводят по уравнению Темкина-Шварцмана
 ,(1.23)
,(1.23)
где М0, М1, М2 и М –2 – постоянные, зависящие от температуры, приведены в справочнике.